Victrelis (Boceprevir)
Victrelis® (Boceprevir)
Abkürzung: BOC
Wirkmechanismus
NS3/4A-HCV-Proteasehemmer
Indikation
Nur HCV-Genotyp 1, Anwendung in Kombination mit pegyliertem Interferon α-2a oder -2b und Ribavirin, nicht als Monotherapie
Galenische Form und Wirkstoffmenge pro Einheit
200mg-Kapseln
Dosierung
3x 800mg p.o. (d.h. 200mg 4-4-4 p.o.) (mit dem Essen)
Therapiedauer
?nach einer 4-wöchigen Lead-in-Phase mit Peg-IFN/RBV allein, zusätzliche BOC-Gabe:
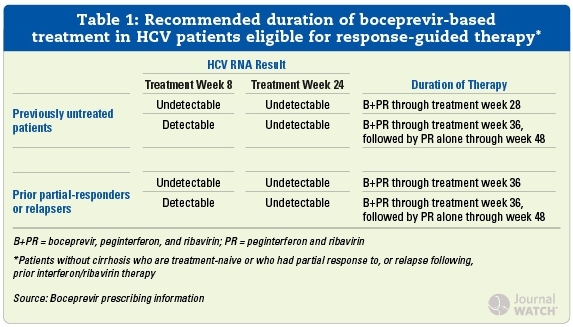
(Kommentar: in der Zulassungsstudie „SPRINT-2“ erhielten alle Therapienaiven in der (RGT) response-guided-therapy-Gruppe nur 24 Wochen kombiniert BOC + Peg-IFN/RBV)
- kompensierte Leberzirrhose
4 Wochen Peg-IFN/RBV → 44 Wochen BOC + Peg-IFN/RBV - HCV-Therapienaive mit <1 log U/ml HCV-RNA-Abfall nach 4 Wochen Peg-IFN/RBV (Poor-Responder in der Lead-in-Phase:)
→ 44 Wochen BOC + Peg-IFN/RBV - frühere Null-Responder auf Peg-IFN/RBV (<2 log HCV-RNA-Abfall Woche 12):
4 Wochen Peg-IFN/RBV → 44 Wochen BOC + Peg-IFN/RBV (cave: BOC in den bisherigen Studien nicht bei früheren Peg-IFN/RBV-Null-Respondern untersucht!)
? BOC + Peg-IFN/RBV-Therapiestopp (stopping-rule), wenn HCV-RNA bei Woche 12 noch >100 U/ml bzw. bei Woche 24 noch immer nachweisbar
Nebenwirkungen
- unter BOC + Peg-IFN/RBV in 49% Hb-Abfall auf <10 g/dl (unter Peg-IFN/RBv allein in 28%)
→ entsprechend häufiger Erythropoetin-Einsatz unter BOC + Peg-IFN/RBV als unter Peg-IFN/RBV allein (43% versus 24%)
→ allerdings BOC-Abbruchrate wegen Anämie nur 1% - Neutropenie und Thrombopenie mit BOC häufiger als ohne
- Geschmacksstörungen: 35-44% unter BOC + Peg-IFN/RBV versus 11-16% unter Peg-IFN/RBV allein
Interaktionen
- BOC = starker CYP3A4-Inhibitor (und gleichzeitig CYP3A4-Substrat)
→ keine gleichzeitige Gabe von:- Alfuzosin (Xatral®, α1-Blocker, Prostatahyperplasie, CYP3A4-Substrat)
- Rifampicin (Rimactan®, Antibiotikum, starker CYP3A4-Inducer)
- Simvastatin (Zocor®, Statin, CYP3A4-Substrat)
- Carbamazepin (Tegretol®, Antiepileptikum, CYP3A4-Substrat)
- Phenytoin (Antiepileptikum, starker CYP3A4-Inducer)
- orales Midazolam (Dormicum®, Benzodiazepin, CYP3A4-Substrat → AUC (area under the curve) 5x↑)
- gleichzeitige Gabe von BOC mit Peg-IFN oder Tenofovir (TDF, HIV-Medikament (NRTI)): → keine Dosisanpassung nötig
- gleichzeitige Gabe von BOC mit Efavirenz (EFV, HIV-Medikament (NNRTI)): → BOC-Tal-Spiegel um 50%↓
- gleichzeitige Gabe von BOC mit Drospirenon/Ethinyl-Estradiol → keine Einbusse der kontrazeptiven Wirkung zu erwarten
- bzgl. BOC und Methadon bislang keine Interaktionsstudien
Elimination
- vorwiegend hepatisch metabolisiert
- Ausscheidung zu 9% mit dem Urin und zu fast 80% mit dem Stuhl
Resistenzentwicklung
- Ja, v.a. unter BOC-Monotherapie (deshalb nur in Kombination mit Peg-IFN/RBV!) bzw. bei eingeschränkter Peg-IFN/RBV-Wirksamkeit (d.h. <1 log HCV-RNA-Abfall während der 4-wöchigen Lead-in-Phase)
(SPRINT-2:- ≥1 log U/ml HCV-RNA-Abfall nach 4 Wochen Peg-IFN/RBV-lead-in: → nur in 4% BOC-Resistenzentwicklung, SVR-Rate 82%.
- <1 log U/ml HCV-RNA-Abfall nach 4 Wochen Peg-IFN/RBV-lead-in: → in 35-50% BOC-Resistenzentwicklung, SVR-Rate nur noch 30-40%)
- in SPRINT2- und RESPOND-2 Nachweis von BOC-Resistenzen bei ca. der Hälfte der Patienten ohne SVR → unter BOC mit einer Häufigkeit von >25% zu beobachtende Resistenzen für Genotyp 1a und 1b unterschiedlich
(Gt 1a: V36M, R155K; Gt 1b: T54A, T54S, A156S, V170A)
- nach ca. 2 Jahren ca. 50% der BOC-Resistenzen wieder zum Wildtyp zurückmutiert (je grösser der Fitness-Verlust, desto schneller
→ schnelle Rückkehr zum Wildtyp: V36M und T54A, langsame Rückkehr zum Wildtyp: T54S, R155K
→ bislang unklar, ob die Resistenzmutationen im Falle einer HCV-Proteasehemmer-Reexposition (erneuter Selektionsdruck) wieder zu Tage treten
- Cave: Kreuzresistenz zwischen Boceprevir und Telaprevir (Peg-IFN/RBV bleiben wirksam)
Preis
200mg-Kapsel: 13,19 CHF
→ Tagesdosis (12 Kapseln): 158,32 CHF
→ Wochendosis: 1108,24 CHF
→ 4 Wochen (Monat): 4432,95 CHF (336 Kapseln)
→ 24 Wochen: 26.597,70 CHF
→ 32 Wochen: 35.463,60 CHF
→ 44 Wochen (maximale Therapiedauer): 48.762,45 CHF
Zulassung
FDA-Zulassung 13.05.2011 (noch keine Zulassung für HIV-Koinfizierte
Kommentar/Zusatzinformation
SPRINT-2-Studie (Peg-IFN = Peg-IFN &ALPHA;-2b)
- 1097 HCV-monoinfizierte, therapie-naive Patienten mit HCV-Genotyp 1 (159 Schwarze; 938 Nicht-Schwarze)
→ nach einer 4-wöchigen Lead-in-Phase mit Peg-IFN/RBV:- BOC + Peg-IFN/RBV für 24 Wochen → danach nochmals 20 Wochen Peg-IFN/RBV allein, falls HCV-RNA bei Woche 8 noch detektierbar (RGT (reponse-guided therapy)-Gruppe)
- BOC + Peg-IFN/RBV für 44 Wochen (fixed-duration group)
- Peg-IFN/RBV + Placebo für 44 Wochen (Kontrollgruppe)
- Nicht-Schwarze: signifikant höhere SVR-Raten in den BOC-Gruppen (67-68%) als in der Kontrollgruppe (40%)
- Schwarze: in allen 3 Gruppen niedrigere SVR-Raten, aber BOC + Peg-IFN/RBV dabei immer noch besser als Peg-IFN/RBV (SVR-Rate 42% in der RGT-Gruppe, 53% in der fixed-duration group und 23% in der Kontrollgruppe)
- insgesamt 44% der Patienten in der RGT-Gruppe bereits nach 8 Wochen HCV-RNA-negativ → Therapieverkürzung auf total 28 Wochen
RESPOND-2-Studie (Peg-IFN = Peg-IFN α-2b)
- 403 HCV-monoinfizierte, HCV-Genotyp 1-Patienten mit nur partiellem Ansprechen auf bzw. Relapse nach frühere(r) Peg-IFN/RBV-Therapie (Frühere Null-Responder mit <2 log HCV-RNA-Abfall bei Woche 12 wurden nicht eingeschlossen.)
→ nach einer 4-wöchigen Lead-in-Phase mit Peg-IFN/RBV:- BOC + Peg-IFN/RBV für 32 Wochen → danach nochmals 12 Wochen Peg-IFN/RBV allein, falls HCV-RNA bei Woche 8 noch detektierbar (RGT (response-guided therapy)-Gruppe)
- BOC + Peg-IFN/RBV für 44 Wochen (fixed-duration group)
- Peg-IFN/RBV + Placebo für 44 Wochen (Kontrollgruppe)
- signifikant höhere SVR-Raten in den BOC-Gruppen (59% in der RGT-Gruppe, 66% in der fixed-duration group) als in der Kontrollgruppe (21%)
IL28B
- bei therapienaiven Patienten SVR-Rate bei Vorliegen des günstigen IL28B-Genotyps (CC) durch BOC nicht weiter verbesserbar
? Beachten Sie unseren Disclaimer.