Zukunftsmusik: Interferon-freie HCV-Therapie bei Genotyp 1
Auch mit den neuen HCV-Proteasehemmern Boceprevir und Telaprevir für HCV-Genotyp 1 bleiben pegyliertes Interferon und Ribavirin unverzichtbarer Therapiebestandteil. In Studien werden gegenwärtig jedoch diverse Kombinationen von direkt gegen HCV wirksamen Substanzen getestet, welche ohne Interferon auskommen.
Eine Monotherapie mit den neuen HCV-Proteasehemmern Boceprevir und Telaprevir verbietet sich aufgrund rascher Resistenzentwicklung mit konsekutivem virologischen Versagen. Sie dürfen nur in Kombination mit pegyliertem Interferon (Peg-IFN) und Ribavirin (RBV) eingesetzt werden. Entsprechend besteht für HCV-Patienten, bei denenen eine Interferon-Therapie wegen nicht zu tolerierenden Nebenwirkungen oder Kontraindikationen nicht in Frage kommt, derzeit keine Therapieoption. In vitro- und in vivo-Studien deuten jedoch darauf hin, dass in Zukunft durch Kombination von direkt gegen HCV wirkenden Medikamenten mit unterschiedlichen Angriffspunkten und nicht überlappenden Resistenzprofilen eine Peg-IFN- und RBV-freie HCV-Therapie möglich sein wird.
Dabei ist zu beachten, dass NS3/4A-Proteasehemmer, NS5A-Inhibitoren und NS5B-Nicht-Nukleosid-Polymerasehemmer (NNI = non-nucleoside inhibitor) einen niedrigere genetische Resistenzbarriere aufweisen als NS5B-Nukleosid-Polymerasehemmer (NI = nucleoside inhibitor) (Mc Cown, AAC 2008). Bislang konnte durch Kombination von zwei direkt gegen HCV wirksamen Substanzen (DAAs = direct-acting antiviral agents) mit niedriger genetischer Resistenzbarriere keine dauerhafte Suppression der Virusreplikation erreicht werden. HCV-Varianten mit gleichzeitiger Resistenz gegenüber zwei DAAs scheinen vorzubestehen und unter Therapie selektioniert zu werden. Grundsätzlich gibt es diesbezüglich drei Problemlösungsansätze:
1) DAA-Kombinationen, welche Polymerasehemmer mit einer hohen Resistenzbarriere (NI) enthalten
(z.B. Kombination des NS3/4A-Proteasehemmers Danoprevir (RG7227) mit dem Nukleosid-Polymerasehemmer (NI) Mericitabin (RG7128) (Gane, Lancet 2010)),
2) Triple-DAA-Therapie (d.h. Nicht-Nukleosid-Polymerasehemmer (NNI) + NS3/4A-Proteasehemmer + NS5A-Inhibitor (Rong, Sci Transl Med 2010)) und
3) Kombination von 2 DAAs mit niedriger genetischer Resistenzbarriere mit Ribavirin (RBV)
(z.B. NS3/4A-Proteasehemmer GS-9256 + Nicht-Nukleosid-Polymerasehemmer (NNI) Tegobuvir (GS-9190) + RBV (Zeuzem, Hepatology 2011) oder NS3/4A-Proteasehemmer BI 201335 + NS5B NNI BI 207127 + RBV (Zeuzem, Gastroenterology 2011)).
Im Folgenden werden zwei Studien zu Peg-IFN-freien Therapiemöglichkeiten detaillierter beschrieben:
1) NS3/4A-Proteasehemmer BI 201335 + NS5B-Nicht-Nukleosid-Polymerasehemmer BI 207127 + Ribavirin bei therapienaiven Patienten mit chronischer Hepatitis C Genotyp 1 (SOUND-C1 = Safety and antiviral effect of Oral combination withoUt iNterferon in patients Diagnosed with chronic hepatitis C)
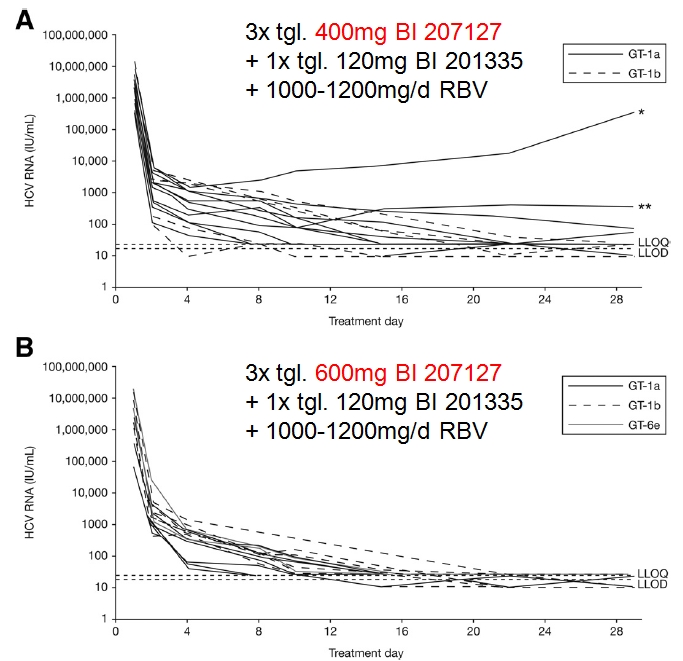
In einer randomisierten, open-label Phase 1b-Multizenter-Studie in Australien, Frankreich, Deutschland, Neuseeland und der Schweiz erhielten 32 therapienaive Patienten mit chronischer Hepatitis C Genotyp 1 entweder 400 oder 600mg des Polymeraseinhibitors BI 207127 3x tgl. + 120mg des Proteasehemmers BI 201335 1x tgl. + Ribavirin 1000-1200mg/d für 4 Wochen. Primärer Endpunkt war eine HCV-RNA <25 U/ml nach vierwöchiger Therapie (RVR = rapid virological response).
In der 3x tgl. 400mg BI 207127-Gruppe erreichten 47%, 67% und 73% an Tag 15, 22 und 29 eine HCV-RNA <25 U/ml, wobei das Therapieansprechen für Genotyp 1b besser war als für Genotyp 1a ("b" = better). In der 3x tgl. 600mg BI 207127-Grupppe lagen die Ansprechraten bei 82%, 100% und 100%, ohne dass Genotyp-spezifische Unterschiede festzustellen waren. (zum Vergleich: Mit Peg-IFN + RBV erreichen ca. 15% der Genotyp 1-Patienten eine RVR. Mit der Kombination Peg-IFN + RBV + Boceprevir oder Telaprevir sind es immerhin ca. 60%.)
Ein Patient mit HCV-Genotyp 1a in der 3x tgl. 400mg-Gruppe zeigte an Tag 22 einen "virological breakthrough" (d.h. Wiederanstieg der HCV-RNA um >= 1 log U/ml unter Therapie), möglicherweise infolge einer etwas geringeren antiviralen Aktivität von BI 207127 gegenüber Genotyp 1a. Die Resistenztestung an Tag 30 ergab eine sowohl gegen BI 201335 als auch gegen BI 207127 resistente Doppelmutante mit veränderten Aminosäuresequenzen in NS3 (R155K) und NS5B (P495L).
*Patient mit "virological breakthrough" an Tag 22, **Patient mit einem HCV-RNA-Anstieg von 0,7 log U/ml gegenüber Nadir, LLOD = lower limit of detection: 17 U/ml, LLOQ = lower limit of quantification: 25 U/ml
Die häufigsten Nebenwirkungen waren milde gastrointestinale Symptome (Diarrhoe, Übelkeit, Erbrechen), Ausschlag und Photosensitivität. Im Labor fiel ein leichter Anstieg der Thrombozytenzahl sowie ein Dosis-abhängiger Anstieg des unkonjugierten Bilirubins ohne Hinweise auf eine begleitende Leberfunktionsstörung auf (Hemmung von Bilirubin-Transportern und konjugierenden Enzymen durch BI 201335 in Gegenwart einer RBV-induzierten Hämolyse). Schwerwiegende Nebenwirkungen wurden nicht beobachtet und es kam zu keinen vorzeitigen Therapieabbrüchen.
An Tag 29 wurden alle Patienten auf 1x tgl. 120mg BI 201335 + Peg-IFN + RBV bis Woche 24 bzw. 48 umgestellt, je nachdem, ob nach 4 Wochen eine rapid virological response (RVR), d.h. HCV-RNA <25 U/ml, erreicht wurde. Im Falle des Patienten mit "virological breakthrough" erfolgte eine Umstellung auf Peg-IFN + RBV für 48 Wochen.
Quelle: Zeuzem S et al., Gastroenterology 2011 [Epub ahead of print] (doi:10.1053/j.gastro.2011.08.051)
2) NS5A-Inhibitor BMS-790052 + NS3-Proteasehemmer BMS-650032 bei HCV-Genotyp 1b-infizierten Nullrespondern
HCV-Genotyp 1 ist weltweit der häufigste und gleichzeitig auch der am schwersten zu behandelnde Genotyp. Genotyp 1b ist dabei weltweit am verbreitetsten und prädominiert in Japan und China, während in den USA Genotyp 1a am häufigsten ist. In Europa kommen beide Subtypen etwa gleich häufig vor.
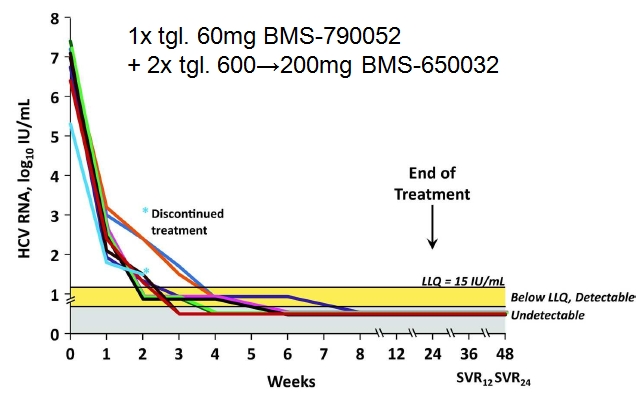
In einer open-label Phase 2a-Studie in Japan wurden HCV-Genotyp 1b-Patienten mit früherer Null-Response auf Peg-IFN + RBV, d.h. HCV-RNA-Abfall <2 log U/ml nach 12 Wochen, während 24 Wochen mit 1x tgl. 60mg (2 Tbl. à 30mg) des NS5A-Replikationskomplexhemmers BMS790052 + initial 2x tgl. 600mg (3 Tbl. à 200mg) des NS3/4A-Proteasehemmers BMS-650032 behandelt (im Verlauf (nach 12-21 Therapiewochen) Dosisreduktion auf 2x tgl. 200mg, da es in einer anderen Studie unter BMS-650032 + Peg-IFN + RBV zu relevanten Transaminasenerhöhungen gekommen war (Bronowicki, J Hepatol 2011)). Primärer Endpunkt war der Anteil Patienten mit SVR12, d.h. sustained virological response 12 Wochen nach Therapieende.
Bei einem Patienten musste die Therapie bereits nach 2 Wochen wegen einer viertgradigen Gesamtbilirubinerhöhung abgebrochen werden. Die übrigen 9 Patienten komplettierten die 24 wöchige Therapie. Bei allen 9 Patienten war nach 8 Wochen keine HCV-RNA mehr nachweisbar (untere Nachweisgrenze: 15 U/ml) und alle erreichten eine SVR12 und SVR24. Auch bei dem Patienten, bei dem die Therapie bereits nach 2 Wochen bei einer HCV-RNA von 1,8 log U/ml gestoppt worden war, fiel die HCV-RNA 2 Wochen nach Therapieabbruch unter der Nachweisgrenze und blieb im Verlauf nicht nachweisbar. (SVR-Raten zum Vergleich: Nonresponder bei erneuter Peg-IFN + RBV-Therapie: 6-9%, Nullresponder bei Re-Therapie mit Peg-IFN + RBV + Telaprevir: 27% für Genotyp 1a und 37% für Genotyp 1b (Zeuzem, NEJM 2011), für Boceprevir keine Daten für Nullresponder)
Obgleich Patienten mit vorgängiger NS5A-Inhibitor- oder NS3/4A-Proteasehemmer-Exposition von der Studienteilnahme ausgeschlossen waren, zeigten sich in der Resistenztestung bei baseline diverse vorbestehende Resistenzmutationen. Nichtsdestotrotz kam es zu keinem "virological breakthrough".
Diarrhoe und Kopfschmerzen (i.d.R. mild) waren die häufigsten Nebenwirkungen. Transaminasenerhöhungen wurden bei 3 Patienten beobachtet, führten jedoch nicht zum Therapieabbruch (keine bemerkenswerten Unterschiede zwischen den Transaminasenwerten vor und nach BMS-650032-Dosisreduktion).
Das sehr gute Therapieansprechen scheint allerdings nicht ohne Weiteres auf HCV-Genotyp 1a-Patienten übertragbar zu sein. In einer ähnlichen, in den USA durchgeführten Studie wurden HCV-Genotyp 1-Nullresponder während 24 Wochen mit BMS-790052 + BMS-650032 plusminus Peg-IFN + RBV behandelt (Lok, J Hepatol 2011). Die Gesamt-SVR-Rate unter Zweiertherapie mit BMS-790052 + BMS-650032 betrug dabei 36%, wobei 2/2 HCV-Genotyp 1b-Patienten, aber nur 2/9 HCV-Genotyp 1a-Patienten eine SVR erreichten (verglichen mit 9/10, welche zusätzlich noch Peg-IFN + RBV erhielten). Das häufige Auftreten von "virological breakthrough" bei HCV-Genotyp 1a-Patienten deutet auf Subtyp-spezifische Unterschiede bzgl. Resistenzbarriere hin.
Quelle: Chayama K et al., Hepatology 2011 [Epub ahead of print] (doi: 10.1002/hep.24724)
Übrigens sind diesen Monat in Hepatology von Ghany et al. die neuen AASLD Practice Guidelines 2011 zur Behandlung der chronischen Hepatitis Genotyp 1 publiziert worden. Sie beinhalten eine Zusammenfassung der bisherigen Studienresultate für Boceprevir und Telaprevir bei therapienaiven und -erfahrenen Patienten (Relapsers, Partial responders, Null responders) und eine Gegenüberstellung der von der FDA empfohlenen Therapieschemata (lead-in-Phase, Therapiedauer basierend auf dem Konzept der "response-guided therapy" und in Abhängigkeit vom Vorliegen einer Zirrhose, stopping rules). Ausserdem werden die unterschiedlichen Nebenwirkungsprofile beider Substanzen, ihr Potential bezüglich Medikamenteninteraktionen und Resistenzentwicklung sowie der Stellenwert von IL28B und lead-in-Phase diskutiert. Empfehlungen, welche Patientengruppen nach Verfügbarwerden von Boceprevir und Telaprevir prioritär behandelt werden sollten, sowie Richtlinien zur Behandlung HIV-HCV-Koinfizierter sucht man in dem Paper dagegen vergebens.
Folgende Internet-Seiten werden zum Nachschlagen von mit Boceprevir bzw. Telaprevir zu erwartenden Medikamenteninteraktionen empfohlen:
1) www.accessdata.fda.gov/scripts/cder/drugsatfda/index.cfm
2) www.hep-druginteractions.org