 .
.
Viele Faktoren stehen unter V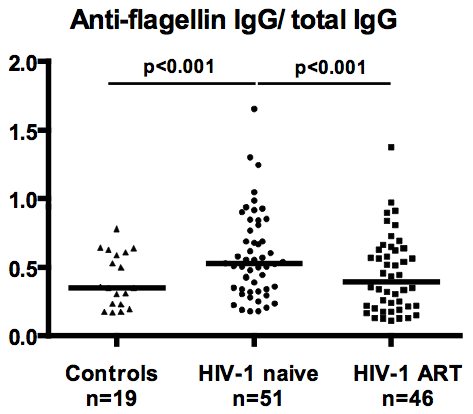 erdacht, die chronische Immunaktivierung zu verursachen. Sie treibt im Verlauf einer HIV-Infektion den vorzeitigen Alterungsprozess voran. Die Viruslast ist dabei allenfalls die Initialzündung. Im Verlauf korreliert sie kaum mehr mit messbarer Immunaktivierung. Ein wahrscheinlich wichtiger Faktor ist die sogenannte Translokation mikrobieller Bestandteile aus dem Darmlumen in den systemischen Kreislauf. Die Gründe dafür sind nicht abschliessend geklärt. Direkt bestimmen lassen sich bakterielle Bestandteile wie z.B. Lipopolysachcharid (LPS) oder indirekte Parameter wie das lösliche CD14 (sCD14) als Marker einer Makrophagenaktivierung. Offenbar lassen sich aber auch deutlich mehr Antikörper gegen Flagellin, einen weiterer Bestandteil einiger Bakterien nachweisen. Die entsprechenden Antikörpertiter reduzieren sich unter einer ART, jedoch normalisieren sich nicht im Vergleich mit der gesunden Kontrollgruppe (siehe Abstract).
erdacht, die chronische Immunaktivierung zu verursachen. Sie treibt im Verlauf einer HIV-Infektion den vorzeitigen Alterungsprozess voran. Die Viruslast ist dabei allenfalls die Initialzündung. Im Verlauf korreliert sie kaum mehr mit messbarer Immunaktivierung. Ein wahrscheinlich wichtiger Faktor ist die sogenannte Translokation mikrobieller Bestandteile aus dem Darmlumen in den systemischen Kreislauf. Die Gründe dafür sind nicht abschliessend geklärt. Direkt bestimmen lassen sich bakterielle Bestandteile wie z.B. Lipopolysachcharid (LPS) oder indirekte Parameter wie das lösliche CD14 (sCD14) als Marker einer Makrophagenaktivierung. Offenbar lassen sich aber auch deutlich mehr Antikörper gegen Flagellin, einen weiterer Bestandteil einiger Bakterien nachweisen. Die entsprechenden Antikörpertiter reduzieren sich unter einer ART, jedoch normalisieren sich nicht im Vergleich mit der gesunden Kontrollgruppe (siehe Abstract).
Welch massiven Auswirkungen eine HIV-Infektion auf die Balance der enteralen Abwehr in der Darmmukosa hat, lässt sich, basierend auf tierexperimentellen Daten, erahnen. In der progressiven SIVmac-Infektion verändern sich Mustererkennungsrezeptoren (pathogen recognition receptors, PRR) wie z.B. toll like receptors (TLR) und Zytokinmuster von der akuten zur chronischen Infektion eindrücklich. Bestimmt wurde jeweils die mRNA der aufgeführten PRR oder Zytokine. Gleichzeitig zeigte sich auch eine Krankheitsprogression. Eine steigende Viruslast, eine abfallende CD4-Zellzahl bei gleichzeitigem Anstieg von LPS im Plasma dokumentieren dies. Wurden die Tiere antiretroviral behandelt oder mit einem attenuierten SI-Virus infiziert, blieb das Muster der akuten Infektion erhalten (siehe Abstract).

Die immunologische Dysbalance im Darm zeigt sich auch in der Funktion antigen-präsentierender Zellen. Die Fähigkeit zur Phagozytose bleibt zwar erhalten. Doch zeigt sich die Reaktion dieser Zellen mit der Bildung proinflammatorischer Zytokine auch gegenüber nicht pathogenen Bakterien wie Lactobacillus plantarum ungünstig verändert. Gleichzeitig erscheint z.B. das Downstream-Signal, welches zur Phosphorylierung von NF-κB führt gestört (siehe Abstract).
Die chronische Entzündung der Darmmukosa während der HIV-Infektion ist einer chronisch entzündlichen Darmerkrankung (IBD) durchaus ähnlich. Auch diese zeigt – wenngleich deutlicher akzentuiert – eine mikrobielle Translokation. Auch serologische IBD-Marker (z.B. ASCA-IgA/IgG, anti-OmpC, anti-CBir1) lassen sich während einer HIV-Infektion nachweisen. Die erhöhten Antikörper überstiegen Werte der gesunden Kontrollgruppe, waren jedoch geringer im Vergleich mit IBD-Patienten (siehe Abstract). Ein Vergleich des fäkalen Calprotectins zwischen beiden Gruppen wurde nicht durchgeführt.
Ähnlich wie bei IBD scheint auch eine HIV-Infektion die Zusammensetzung der Darmflora zu beeinflussen. Führt diese Dysbiosis zu dem sogenannten „leaky gut“ und konsekutiv zur mikrobiellen Translokation? Diese Frage ist nicht beantwortet. Erste Hinweise zeigen lediglich einen möglichen Zusammenhang zwischen der intestinalen Mikrobiota und der Aktivierung von CD4+/CD8+ T-Zellen. Die Fallzahlen (n=16) sind klein und eine Kontrolle für mögliche nutritive Faktoren wurde nicht durchgeführt (siehe Abstract).
Chronische Inflammation führt auch in der Darm
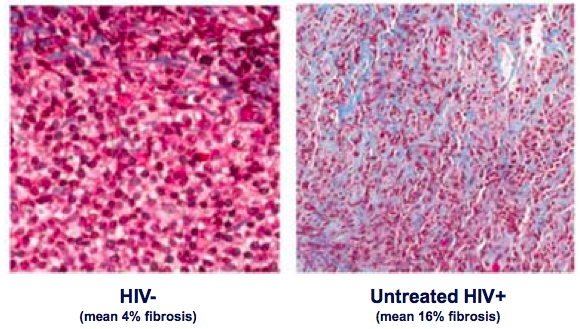
mukosa zur Fibrose. Dies zeigt die Auswertung der Darmbiopsien von 9 HIV-Patienten eindrücklich (siehe nebenstehende Histologien, hellblau = Fibrose). Die Fibrose korreliert auch indirekt mit der CD4-Zellzahl, der Gag-spezifischen Immunantwort der CD8+ T-Lymphozyten (Il-2/IFNg) sowie direkt mit dem Aktivierungszustand (CD38+/HLA-DR+) und dem Erschöpfungszustand (PD1+) der Lymphozyten (siehe
Abstract).
Die intestinalen Veränderungen sind massiv und – obwohl die Frage vom Huhn und dem Ei nicht geklärt ist – korrelieren sie mit mikrobieller Translokation, Immunaktivierung und gleichzeitig mit den für das kardiovaskuläre Risiko wichtigen Inflammations- und Koagulationsparametern (siehe Abstract). Sie zeigen sich bereits im Kindesalter (siehe Abstract). Und – das ist unerfreulich – sie lassen sich kaum durch eine ART beeinflussen. Vor diesem Hintergrund erscheint es dringend notwendig, Möglichkeiten der therapeutischen Einflussnahme auf diese Veränderungen zu prüfen.
Eine wichtige Konsequenz aus dieser immensen Fülle von Daten ist jedoch, dass wir alles daran setzten sollten, eine akute HIV-Infektion sofort zu diagnostizieren und durch eine Therapie diese Veränderungen in der Darmschleimhaut (Zerstörung des lymphatischen Gewebes, Immunaktivierung, Fibrosierung) zu verhindern
 erdacht, die chronische Immunaktivierung zu verursachen. Sie treibt im Verlauf einer HIV-Infektion den vorzeitigen Alterungsprozess voran. Die Viruslast ist dabei allenfalls die Initialzündung. Im Verlauf korreliert sie kaum mehr mit messbarer Immunaktivierung. Ein wahrscheinlich wichtiger Faktor ist die sogenannte Translokation mikrobieller Bestandteile aus dem Darmlumen in den systemischen Kreislauf. Die Gründe dafür sind nicht abschliessend geklärt. Direkt bestimmen lassen sich bakterielle Bestandteile wie z.B. Lipopolysachcharid (LPS) oder indirekte Parameter wie das lösliche CD14 (sCD14) als Marker einer Makrophagenaktivierung. Offenbar lassen sich aber auch deutlich mehr Antikörper gegen Flagellin, einen weiterer Bestandteil einiger Bakterien nachweisen. Die entsprechenden Antikörpertiter reduzieren sich unter einer ART, jedoch normalisieren sich nicht im Vergleich mit der gesunden Kontrollgruppe (siehe Abstract).
erdacht, die chronische Immunaktivierung zu verursachen. Sie treibt im Verlauf einer HIV-Infektion den vorzeitigen Alterungsprozess voran. Die Viruslast ist dabei allenfalls die Initialzündung. Im Verlauf korreliert sie kaum mehr mit messbarer Immunaktivierung. Ein wahrscheinlich wichtiger Faktor ist die sogenannte Translokation mikrobieller Bestandteile aus dem Darmlumen in den systemischen Kreislauf. Die Gründe dafür sind nicht abschliessend geklärt. Direkt bestimmen lassen sich bakterielle Bestandteile wie z.B. Lipopolysachcharid (LPS) oder indirekte Parameter wie das lösliche CD14 (sCD14) als Marker einer Makrophagenaktivierung. Offenbar lassen sich aber auch deutlich mehr Antikörper gegen Flagellin, einen weiterer Bestandteil einiger Bakterien nachweisen. Die entsprechenden Antikörpertiter reduzieren sich unter einer ART, jedoch normalisieren sich nicht im Vergleich mit der gesunden Kontrollgruppe (siehe Abstract). mukosa zur Fibrose. Dies zeigt die Auswertung der Darmbiopsien von 9 HIV-Patienten eindrücklich (siehe nebenstehende Histologien, hellblau = Fibrose). Die Fibrose korreliert auch indirekt mit der CD4-Zellzahl, der Gag-spezifischen Immunantwort der CD8+ T-Lymphozyten (Il-2/IFNg) sowie direkt mit dem Aktivierungszustand (CD38+/HLA-DR+) und dem Erschöpfungszustand (PD1+) der Lymphozyten (siehe Abstract).
mukosa zur Fibrose. Dies zeigt die Auswertung der Darmbiopsien von 9 HIV-Patienten eindrücklich (siehe nebenstehende Histologien, hellblau = Fibrose). Die Fibrose korreliert auch indirekt mit der CD4-Zellzahl, der Gag-spezifischen Immunantwort der CD8+ T-Lymphozyten (Il-2/IFNg) sowie direkt mit dem Aktivierungszustand (CD38+/HLA-DR+) und dem Erschöpfungszustand (PD1+) der Lymphozyten (siehe Abstract).

