HLA-B57 mit spontaner Clearance/Elimination des Hepatitis C-Virus assoziiert
Für die Impfstoffentwicklung ist von Interesse, worin sich die Immunantwort bei spontaner HCV-Clearance von der bei chronischer Hepatitis C (persistierende Virämie) unterscheidet. HLA-B57-Positive scheinen nicht nur bzgl. HIV-, sondern auch bzgl. HCV-Kontrolle Vorteile zu haben.
T-Zellen können "ihr" einziges Antigen nur erkennen, wenn es ihnen an ein HLA (human leukocyte antigen; membranassoziiertes Glykoprotein) gekoppelt präsentiert wird (HLA-Restriktion). MHC (mayor histocompatibility complex) sind die Gene, welche die HLA-Proteine kodieren. CD4-T-Helferzellen (welche B-Zellen zur Antikörperproduktion stimulieren) benötigen HLA der Klasse II (beim Menschen HLA DP, DQ, DR), zytotoxische CD8-T-Zellen dagegen HLA der Klasse I (beim Menschen HLA A, B und C). Letztere (HLA Klasse I) kommen auf allen kernhaltigen Zellen des Körpers vor, HLA Klasse II hingegen nur auf Zellen der Immunabwehr, die auch phagozytieren können. Gewisse Krankheiten sind HLA-assoziiert: z.B. M. Bechterew und M. Reiter (HLA-B27), Diabetes mellitus Typ 1 (HLA-DR3 und/oder -DR4) und die Abacavir-Hypersensitivitätsreaktion (HLA-B57.01).
Man geht davon aus, dass CD8-T-Zellen, welche virales Antigen im Kontext von HLA Klasse I erkennen, für die Elimination von HCV eine entscheidende Rolle spielen. Somit ist zu vermuten, dass genetische Unterschiede in HLA Klasse I-Allelen den natürlichen Verlauf der HCV-Infektion (spontane Clearance versus Virus-Persistenz) beeinflussen können. Bei der HIV-Infektion sind die HLA-B57-, HLA-B58- und HLA-B27-Allele mit niedriger Viruslast und langsamerer klinischer Krankheitsprogression assoziiert (sog. "Long-Term-Non-Progressor").
Vor diesem Hintergrund wurde in einer US-Kohorte von 346 anti-HCV-Positiven, welche zwischen 1998 und 2007 an drei verschiedenen Ambulatorien rekrutiert wurden (mehrheitlich HCV-Genotyp 1a, 45% HIV-koinfiziert, 66 Patienten mit spontaner Clearance, 280 Patienten mit chronischer HCV-Infektion), der Einfluss bestimmter HLA Klasse I-Allele auf die spontane HCV-Clearance untersucht.
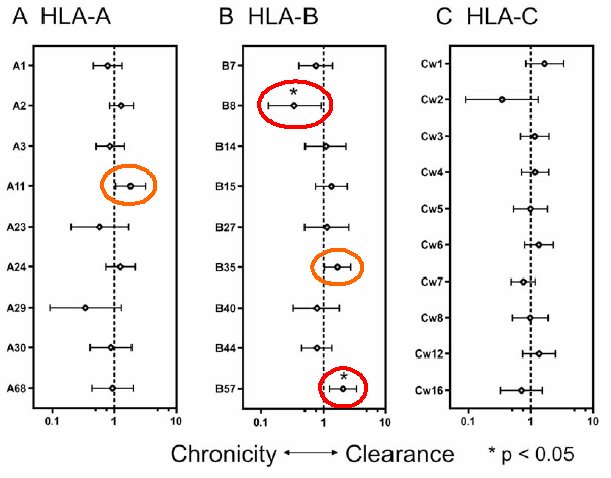
Es fand sich eine signifikante Assoziation zwischen HLA-B57 und spontaner HCV-Clearance (34% versus 17%, RR 2,0 (95%-CI: 1,2-3,4)) sowie ein Trend hin zur spontanen Viruselimination für HLA-A11 und HLA-B35 (RR 1,8 (95%-CI: 1,1,-3,2) bzw. RR 1,65 (95%-CI: 1,0-2,7)). Im Gegensatz dazu war HLA-B08 mit einer niedrigeren spontanen HCV-Clearance-Rate assoziiert (7% versus 21%, RR 0,34 (95%-CI: 0,1-0,9)) (vgl. Abb. 1).
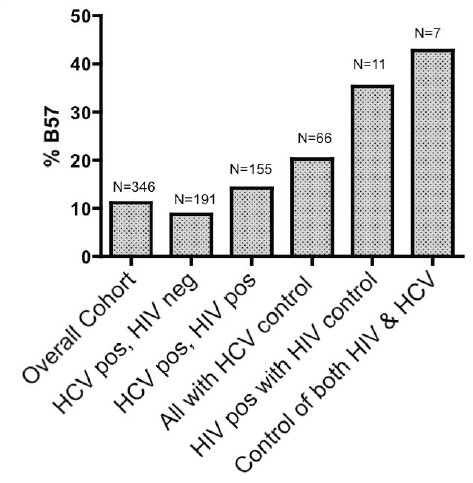
Stratifiziert nach HIV-Status war der protektive Effekt von HLA-B57 bei HIV-Negativen mit OR 4,8 (95%-CI: 1,65-14,3) ausgeprägter als bei HIV-Positiven mit OR 1,5 (95%-CI: 0,53-4,12). In einer 7 Patienten umfassenden Subgruppe, die sowohl HIV als auch HCV zu kontrollieren vermochte (d.h. HIV-positiv und HIV-RNA <2000 (3,3 log) Kop/ml ohne HIV-Therapie und HCV-positiv mit spontaner HCV-Clearance = 2x nicht nachweisbarer HCV-RNA im Abstand von mind. 3 Monaten ohne vorherige HCV-Therapie), war HLA-B57 verglichen mit der übrigen Kohorte überrepräsentiert (RR 6,0 (95%-CI: 1,40-26,0) (vgl. Abb. 2).
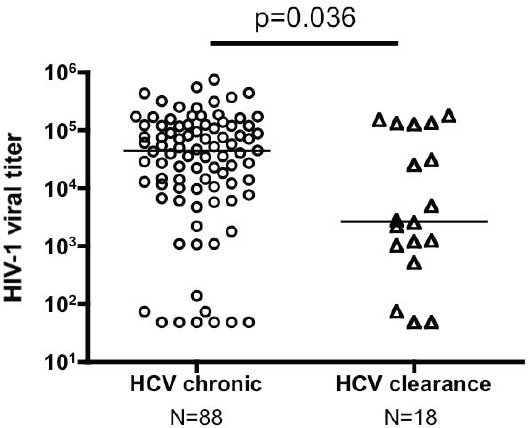
Bei 106/155 HIV-HCV-Koinfizierten wurde der HIV-viral setpoint bestimmt (Mittelwert aller vor HIV-Therapie-Beginn verfügbaren HIV-RNA-Werte, mindestens 1 Jahr nachdem die HIV-Infektion erworben wurde). HCV-Clearance war mit einem signifikant tieferen HIV-viral setpoint assoziiert (median 3,4 log, IQR: 2,8-5,1 log Kop/ml) als chronische HCV-Infektion (median 4,6 log, IQR: 4,0-5,1 log Kop/ml) (vgl. Abb. 3).
In einem nächsten Schritt wurde mittels ex vivo Interferon-gamma ELISpot-Assay die HCV-spezifische CD8-T-Zellantwort in PBMCs (peripheral blood monocyte) bei 8 HLA-B57-Trägern mit spontaner HCV-Clearance näher charakterisiert. Dabei dominierte die Antwort gegen zwei Virus-Epitope, welche sich im Bereich E2 (E = envelope, Hüllprotein) bzw. NS5 (NS = Nicht-Struktur-Protein) befinden. PBMCs von 8 HLA-B57-Trägern mit chronischer Hepatitis C zeigten auf diese beiden Epitope im ex vivo ELISpot primär keine Antwort, sondern erst nach Stimulation der PBMCs mit Peptiden (eines HCV-Genotyp 1a-Refernzstamms) und Interleukin-2.
Schliesslich wurden bei 134 Patientent mit chronischer HCV-Genotyp 1a-Infektion die Virus-Sequenzen bei Patienten mit und ohne HLA-B57 verglichen. Bei den HLA-B57-Trägern fand sich eine starke Häufung von Variationen in den HLA-B57-restriktiven Epitopen im Bereich E2 (OR 39) und NS5 (OR 13), was darauf hindeutet, dass sich das HC-Virus in diesen Fällen erfolgreich der Immunantwort entzogen hat und damit der protektive Effekt von HLA-B57 verlorenging. Dies erklärt auch, warum HLA-B57 bei einem single-source outbreak bei Irischen Frauen, die mit HCV Genotyp 1b kontaminierte Immunoglobuline erhielten, keinen Schutz bot. Die Sequenzanalyse des Irischen HCV-Stamms zeigte Mutationen in den HLA-B57-restriktiven Epitopen im Bereich E2 und NS5, die eine Erkennung durch das Immunsystem der HLA-B57-Träger verhinderte. Wie sich auch in weiteren Untersuchungen an HLA-B57-Trägern mit akuter HCV-Infektion bestätigte, kann die Virus-Persistenz durch ein bereits bei Infektion in den entsprechenden immunogenen Epitopen mutiertes Virus oder/und ein primär sensibles, aber unter dem Druck des Immunsystems des Wirts sich im Verlauf veränderndes Virus (sog. viral escape) erklärt werden.
Während die HLA-B57-restriktiven Epitope bei HCV offensichtlich eine grosse Diversität zeigen, sind die HLA-B57-restriktiven Epitope bei HIV über die verschiedenen HIV-1-Clades erstaunlich gut konserviert. Mutationen in solchen Schlüssel-Epitopen können für das Virus auch einen Fitness-Verlust bedeuten und somit von Nachteil sein.
Quelle: Kim et al., Gastroenterology 2010 [Epud ahead of print]