Wenn die Pilztherapie versagt…
Invasive Pilzinfekte haben eine hohe Mortalitaet und Morbiditaet, obwohl seit 1990 einige neue Medikamente auf den Markt gekommen sind. Wie soll man bei einem Therapieversagen vorgehen und v.a. wann muss man von einem Therapieversagen sprechen?
Die Autoren eines Reviewartikels im CID versuchen einige grundsaetzliche Regeln zum Management von Pilzinfektionen zu geben. Es werden Inzidenz, Differentialdiagnose und Management von antifungalem Therapieversagen diskutiert. Nicht viel neues, aber einigie Gedankenstützen.
Pilzinfekte sind trotz oder gerade auch wegen neuer Medikamente und Therapien weiterhin ein relevantes klinisches Problem. Ca. 70-90% der invasiven Pilzinfekte sind Candida species zuzuschreiben, etwa 10-20% den Aspergillen. Die Mortalität wird auf 40-60% bzw. 60-90% angegeben! Gemäss Funginos ist Candida der 7. häufigste Keim für eine Sepsis in der CH.
Im Zusammenhang mit der HIV-Epidemie wurden einige neue Substanzklassen entwickelt und Medikamente zugelassen und trotzdem ist das Therapieversagen bei invasiven Pilzinfekten ein klinisch häufiges Problem geblieben. Die Autoren des Artikels geben dazu folgende Zahlen:
- 20-60% Therapieversagen bei invasiver Candidiasis
- 40-70% bei invasiver Aspergillose
- 30-100% bei Fusariose
Wir Kliniker denken dabei oft primär an ein Resistenzproblem und haben die Tendenz, die Therapie zu wechseln oder eine weitere Substanz dazuzugeben. Die Autoren betonen hier, was man als weitere wichtige Punkte beachten muss: Insbesondere der Immunstatus des Patienten sowie die Pharmakokinetik und Pharmakodynamik spielen eine nicht zu unterschätzende Rolle für ein Therapieversagen.
Definition von Therapieversagen?
Dies zu diangostizieren ist oft schwierig, es gibt keine klaren Richtlinien. Wenn eine klinische Verschlechterung unter der Therapie auftritt kann es sich alternativ auch um einen bakteriellen oder viralen Co-Infekt handeln oder um ein IRIS. Umgekehrt bestätigen uns auch im Verlauf negative Kulturresultate nicht ein anprechen auf die Therapie (geringe Sensitivität). Es ist auch nicht klar, ab wann nach Therapiebeginn eine positive Kultur oder eine weiterhin bestehende Klinik ein Therapieversagen bedeutet. Hier sind Serologien teilweise hilfreich. Einige Daten zeigen, dass ein persistierend hohes Galakotmannan ein Therapieversagen bedeuten kann.
Zum Vergrössern, bitte Bild anklicken
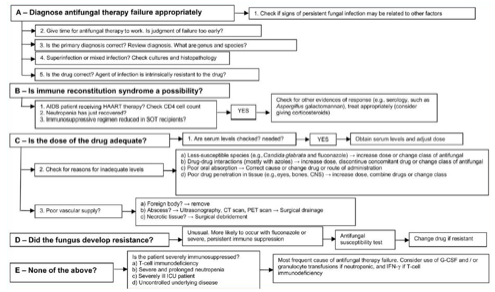
Aufgrund der schwierigen Entscheidung – Therapieversagen oder etwas anderes?- geben die Autoren ein Schema vor mit Fragen, welche helfen sollen, systematisch die invasive Pilzinfektion als ‚Ausschlussdiagnose‘ zu bestätigen:
Differentialdiagnose des Therapieversagen?
Der Wirt:
Gemäss den Autoren der stärkste prognostische Faktor. Eine Erholung des Immunsytem ist oft assoziert mit einer klinischen Verbesserung. Es gibt jedoch wenig Daten, die den Wert von Immunmodulatoren wie GCSF zur Verhinderung von invasiven Pilzinfekten zeigen. Ob es sich um ein IRIS handelt ist oft auch unklar, die Klinik und das Timing müssen uns helfen, uns für Steroide statt für einen Therapiewechsel zu entscheiden.
Der Pilz:
Hier stellt sich die Frage der intrinsischen bzw erworbenen Resistenz. Die klinisch bedeutsamen intrinsichen Resistenzen sind folgende:
- C.krusei (Fluconazol)
- Scedosporium (Ampho B)
- A. terreus (Ampho B)
- Zygomyceten (Vfend)
Ein Labor mit Expertise ist hier wichtig, insbesondere zur Speziesidentifikation bzw zur Invitro-resistenztestung. Jedoch gibt es auch hier Stolpersteine, beispielsweise sind viele Breakpoints für die Resistenzablesung noch nicht definiert.
Erworbene Resistenz:
Da MIC und klinisches Outcome nicht klar korrelieren ist auch hier zu erwähnen, dass für die Resistenzprüfung nicht für alle Pilze Breakpoints gibt, ausser für Azole und Candida. Die meist nachgewiesene erworbene Resistenz ergibt sich bei C. glabrata und Azolgebrauch oder bei Candida sp. unter Caspofungin. Eine Resistenz von Cryptokokken gegen Fluconazol ist auch bekannt. Eine Studie zeigte jedoch, dass beispielsweise Aspergillus fumigatus kaum resistent wird unter Ampho B.
Medikamentenpiegel am Ort des Geschehens?
Gründe für zu tiefe Spiegel können sein:
- Fremdkörper
- Endovasculäre Infekte
- ZNS-Infekte
- Abzesse
- Knochen
Hier spielen Pharmakokinetik/Dynamik eine Rolle, bzw Biofilme (FK, Endokarditis). Weitere Gründe sind eine schlechte Vaskularisierung (Nekrose, Absezss), meist sind es jedoch mehrere Faktoren. Z.B. Candida hat in Biofilmen eine hohe MIC, sodass ein besserer Zugang mit AmphoB oder Cancidas als mit Azolen möglich ist. Meist ist jedoch eine FK-entfernung nötig -> alle Katheter etc. entfernen!
Pharmakokinetik als Ursache
Hier muss an folgendes gedacht werden:
- Interaktionen
- Verschiede Metabolisierungsgeschwindigkeiten der antifungalen Medikamente
- Verminderte orale Absorption
- inadäquate Dosis (zb 400mg Diflucan zu wenig für C. galbrata)
Dazu ist aber insgesamt anzumerken, dass sich in einem Vergleich von 3mg/kg liposomalem Ampho B mit 10mg/kg keine Besserung zeigte! Es gibt auch kaum Daten, die eine Dosiserhöhung als Therapieverbesserung belegen – obwohl dies oft gemacht wird.
Falsche Diagnose oder mixed Infektion
Hier bleibt nur erneut überdenken und allenfalls erneute PCR oder Histo zur Speciesidentifikation.
Management des Therapieversagens?
Das ganze ist einfach und doch komplex! Die Autoren empfehlen die Fragen gemäss dem Schema durchzugehen und legen zum Schluss einige Prinzipien fest:
- Meist versagt die Therapie wegen schlechtem Outcome der Grunderkrankung
- Man soll versuchen das Versagen zu beweisen (kein Abfall der Biomarker, keine Elimination der lebenden Pilze aus dem Gewebe)
- Medikamentenspiegel messen
- Versuch Immunsuppression zu reduzieren (Medikamente) oder Immunmodulatoren dazuzugeben (keine Evidenz?!)
- Chirurgische Entfernung des nekrotischen Gewebes und der FK
- Dosisänderung oder Klassenwechsel und allenfalls Kombinationstherapie obwohl nur wenig Daten exsistieren
Zusammenfassend ist zu sagen, dass ein Therapieversagen häufig ist, wir denken meist an eine Resistenzentwicklung, was jedoch selten ist. Andere Faktoren wie die Grundkrankheit, die Pharmakokinetik/Dynamik spielen eine grosse Rolle. Die Identifikation dessen ist aber schwierig. Uns fehlen klare Biomarker. Vielleicht wird in Zukunft das PET eingesetzt, dies ist jeodch nicht spezifisch. Im Moment scheint Galaktomannan ein Marker zu sein für Aspergillus-Infekte bei neutropenen Patienten mit Malignom. Eine PCR für Aspergillen scheint vielversprechend, Umweltkontaminationen und die DNA-Extraktion stellen aber offenbar ein Problem dar.
Eigentlich schreiben sie nichts neues, aber eine Gedankenstüze für eine Reevaluation kann man sich hier vielleicht holen.