Interferon-freie Behandlungen
Die Zukunft der HCV-Therapie ist zweifelsfrei ohne Interferon. Die Entwicklung auf diesem Feld ist rasant. Wir können hier nur einige wenige der nächsten Kandidaten vorstellen.
Protease- PLUS Polymerasehemmer PLUS Ribavirin: Die Abbott Variante
Ein Beispiel für die interferon-freie Tripletherapie hat Abbott präsentiert. Der Proteasehemmer ABT-450 wird mit Ritonavir geboostet (/r), kombiniert mit einem non-Nuke Polymerasehemmer (ABT-072, oder ABT-333, je 11 oder 33 Patienten) und RBV (Abstr 38). Die Kombination zeigte einen sehr erfreulichen Therapieerfolg bei therapie-naiven Patienten (n=44). Nach 2 Wochen Therapie war bei allen HCV-RNA <25 IU/ml oder nicht nachweisbar. Neu wurden die SVR24-Daten gezeigt. Es besteht weiterhin ein sehr gutes Therapie-ansprechen von >90% auch 24 Wochen nach Therapieende. Nur bei einem Patienten kam es zu einem späten Relapse. Ungenügend war die Wirkung dagegen bei INF-Non-Respondern (n=17; 60% Partial-Responder, 40% Null-Responder), wo es bei 6 Patienten zu einem break-through und bei 2 weiteren Patienten zu einem early relapse gekommen ist. Eindrücklich ist auch die sehr gute Verträglichkeit dieser Kombinationstherapie. Mal schauen, wie verträglich diese neuen Kombinationen für’s Portemonnaie sein werden…
Und gleich noch einen drauf: 4er-Kombination bei INF-Nullrespondern (AVIATOR) 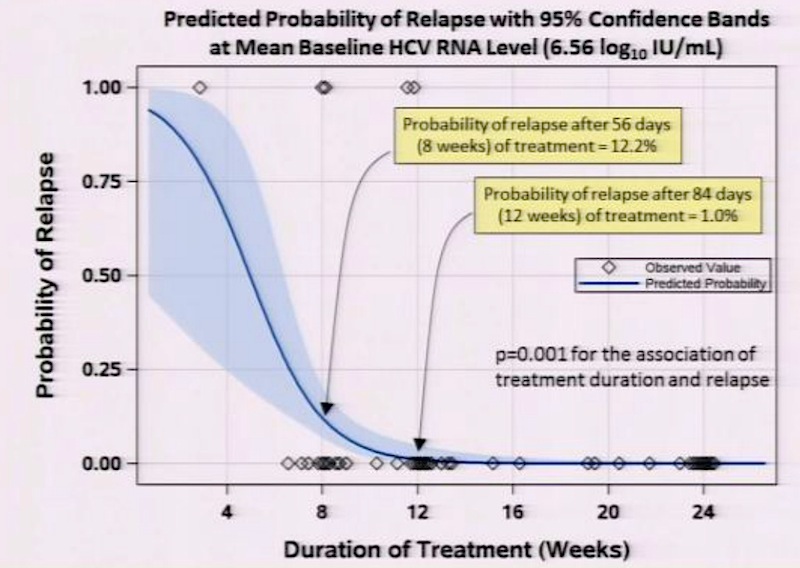
Ergänzt man die oben beschriebene Tripletherapie (ABT-450/r+ABT-333+RBV) noch gleich mit einem weiteren NS5A-Inhibitor (ABT-267, 25mg qd), sieht die Sache noch besser aus (Abstr 39), wobei erst Woche 12-Daten vollständig sind. Die Studie mit diversen, leicht unterschiedlichen Behandlungsgruppen behandelte immerhin 321 Patienten, die meisten eben mit einer INF-freien 4er-Therapie. Bei 12-wöchiger Therapie zeigte sich erwartungsgemäss auch hier eine >90% SVR12-Rate (ITT-Analyse). Nur ein Patient zeigte eine schlechte Adhärenz (im MEMS-caps) und einen vorzeitigen Therapieabbruch. Die geringe Abbruchrate unterstreicht die gute Verträglichkeit der Therapie. Hauptprobleme und Müdigkeit und eine harmlose Bilirubinerhöhung wurden als mild eingestuft.
Erfreulich ist vor allem die hohe SVR12-Rate bei den früheren Null-Respondern mit einer SVR12-Rare von 89% unter 12-wöchigen 3er-Therapie (ABT-450/r + ABT-267 + RBV; n=45) und einer SVR12-Rate von sage und schreibe 93% mit der 4er-Therapie (n=45). In der Studie wurde auch die optimale Behandlungsdauer ermittelt, sie beträgt 12 Wochen. Eine 8-wöchige Therapie führte zu einer Relapse-Rate von 12.2%, bei 12 Behandlungswochen zeigte nur 1% der Patienten einen Relapse. Eine Verlängerung der Therapie brachte nichts. Der IL28B-Genotyp war nicht mit Relapse assoziiert.
Electron-Studie: Elektrisierende Resultate
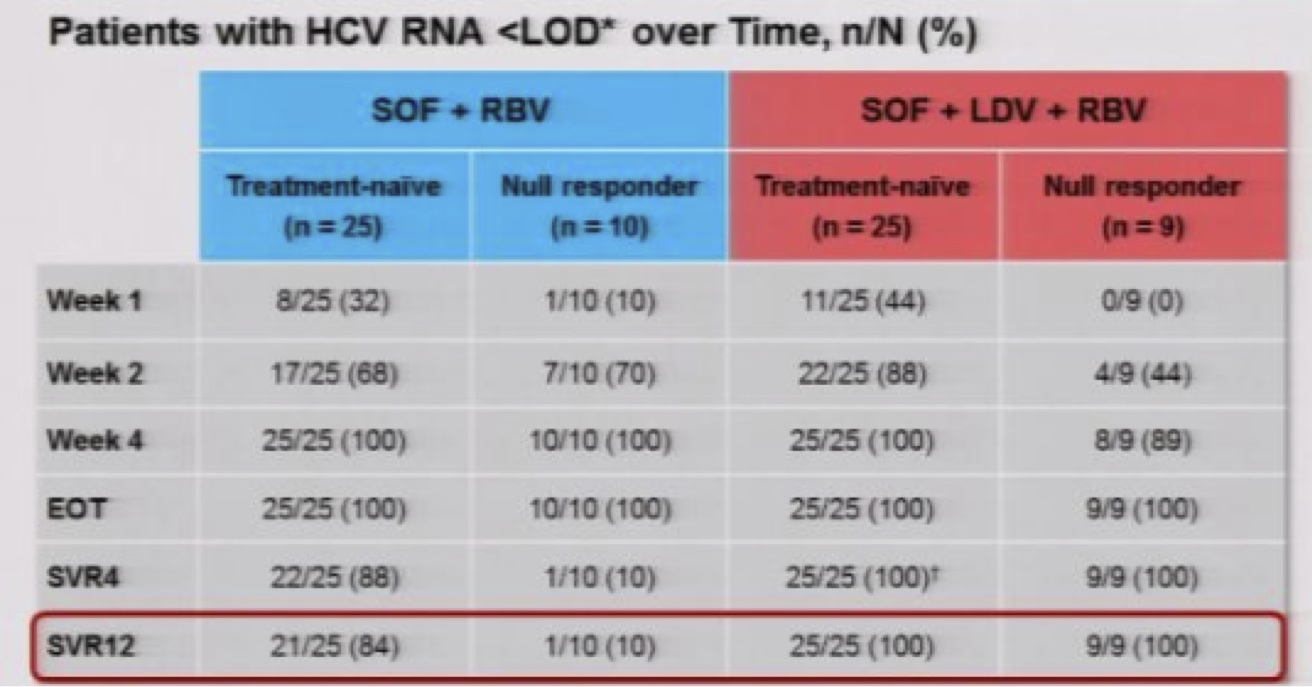 Erfreulicherweise hat sich die am AASLD-Kongress bereits vorangekündigte Erfolgsgeschichte der Kombination von SOF (Polymerasehemmer) mit dem NS5A-Hemmer mit dem neuen Namen Ledipasvir (LDV) und Ribavin bestätigt. 100% Therapieerfolg auch 12 Wochen nach Abschluss der 12-wöchigen Therapie, allerdings bei kleinen Fallzahlen (25 Th-Naïve, 10 Null-Responder). Die Verträglichkeit beider DAAs ist ausgezeichnet und eine Co-Formulierung geplant.
Erfreulicherweise hat sich die am AASLD-Kongress bereits vorangekündigte Erfolgsgeschichte der Kombination von SOF (Polymerasehemmer) mit dem NS5A-Hemmer mit dem neuen Namen Ledipasvir (LDV) und Ribavin bestätigt. 100% Therapieerfolg auch 12 Wochen nach Abschluss der 12-wöchigen Therapie, allerdings bei kleinen Fallzahlen (25 Th-Naïve, 10 Null-Responder). Die Verträglichkeit beider DAAs ist ausgezeichnet und eine Co-Formulierung geplant.
Faldapervir: Pharmakokinetische Interaktionen mit ARVs
Faldaprevir (FDV) wird aktuell in Phase III-Studien geprüft und (neben Simeprevir) voraussichtlich der nächste HCV-Proteasehemmer sein, der auf den Markt kommt. Vorteile sind die einmal-tägliche Einnahme und das, soweit absehbar, günstigere Verträglichkeits¬profil im Vergleich zu den 1.Generations-Proteasehemmern. Aber auch Faldaprevir wird über hepatische Cytochrome metabolisiert. Interaktionen mit HIV-Medikamenten sind also zu erwarten. An gesunden Freiwilligen wurde die Interaktion mit ritonavir-geboostetem Darunavir (DRV/r), Efavirenz (EFV) und Tenofovir (TNV) untersucht. Es fand sich eine leichte Erhöhung von DRV/r (AUC +15%) und TFV (AUC +22%), was klinisch nicht von Bedeutung sein dürfte. Die FDV-Spiegel wurden durch TFV leicht gesenkt (AUC -22%), durch EFV leicht erhöht (AUC +35%) und durch DRV/r deutlich erhöht (AUC +130%). Somit wurde für die Folgestudien zusammen mit DRV/r eine Dosisreduktion von FDV 240mg qd auf 120mg qd empfohlen.
Interim W12 Daten von Faldaprevir bei Koinfizierten vielversprechend 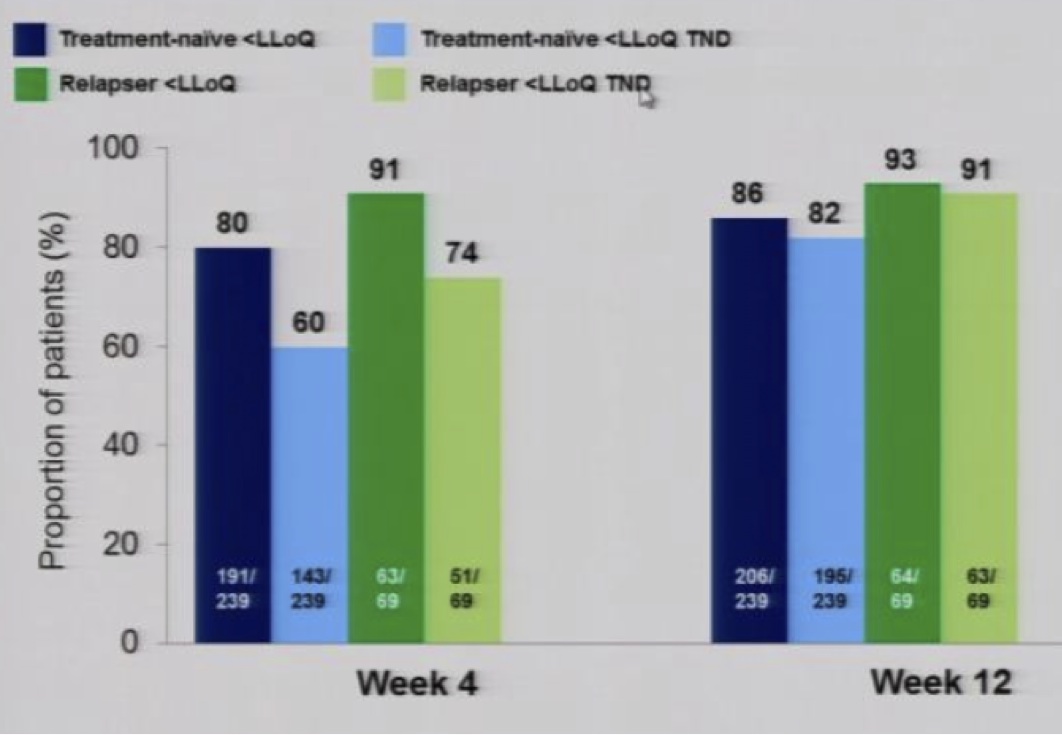
In der STARTVerso 4-Studie werden 308 koinfizierte Patienten (239 Th-Naïve, 69 Relapser) mit Faldaprevir zusammen mit PegINF + RBV behandelt (Abstr 40LB). Das Studiendesign ist im Bild ersichtlich. Die Resultate der Interimsanalyse sind vielversprechend. >80% zeigen einen early treatment success und kommen nun, je nach Randomisierung möglicherweise zu einer verkürzten Therapie. Die Resultate bei Woche 12 (Wirksamkeit und Verträglichkeit) sind gleich gut wie bei HCV-Monoinfizierten (SILEN-C1 Studie).
