Incivo (Telaprevir)
? Beachten Sie unseren Disclaimer
Abkürzung
TVR
Wirkmechanismus
NS3/4A-HCV-Proteasehemmer
Indikation
Nur HCV-Genotyp 1, Anwendung in Kombination mit pegyliertem Interferon α-2a oder -2b und Ribavirin, nicht als Monotherapie
Galenische Form und Wirkstoffmenge pro Einheit
375mg-Tabletten
(gelbe kapselförmige Filmtabletten von etwa 20 mm Länge, auf einer Seite mit «T375» beschriftet)
Dosierung
3x 750mg p.o. (d.h. 375mg 2-2-2 p.o.) (mit dem Essen)
(mögliche Alternative (z.B. bei DOT (directly observed therapy):
2x 1125mg p.o. (d.h. 375mg 3-0-3 p.o.) (mit dem Essen))
Therapiedauer
→ TVR + Peg-IFN/RBV für 12 Wochen (ohne Lead-in) → anschliessend in Abhängigkeit von virologischem Ansprechen unter Therapie sowie Therapievorgeschichte weitere 12 oder 36 Wochen Peg-IFN/RBV allein (d.h. Gesamttherapiedauer: 24 oder 48 Wochen):
- therapienaiv, Leberzirrhose, HCV-RNA negativ Woche 4:
→ evtl. besser auch 12 Wochen TVR + Peg-IFN/RBV → 36 Wochen Peg-IFN/RBV
- früheres partielles Ansprechen auf Peg-IFN/RBV (d.h. ≥ 2 log U/ml HCV-RNA-Abfall Woche 12):
→ 12 Wochen TVR + Peg-IFN/RBV → 36 Wochen Peg-IFN/RBV allein
- frühere Null-Responder auf Peg-IFN/RBV (<2 log HCV-RNA-Abfall Woche 12):
→ 12 Wochen TVR + Peg-IFN/RBV → 36 Wochen Peg-IFN/RBV allein
? TVR + Peg-IFN/RBV-Therapiestopp (stopping-rule)
wenn HCV-RNA bei Woche 4 oder 12 ≥1000 U/ml bzw. bei Woche 24 noch immer nachweisbar
Nebenwirkungen
- Hauptnebenwirkungen: Ausschlag, Anämie, Übelkeit und andere gastrointestinale Symptome, Geschmacksstörungen, anorektale Beschwerden
- Ausschlag: 56% unter TVR + Peg-IFN/RBV versus 34% unter Peg-IFN/RBV allein
(schwerer Ausschlag: 4% unter TVR + Peg-IFN/RBV versus <1% unter Peg-IFN/RBV allein)
→ milder bis moderater Ausschlag → Fortsetzung der Therapie unter engmaschiger Kontrolle
→ TVR stopp, bei massiver Zunahme des Ausschlages bzw. Auftreten systemischer Symptome - unter TVR + Peg-IFN/RBV in 36% Hb-Abfall auf <10g/dl (vs. 17% unter Peg-IFN/RBV allein)
(in Telaprevir-Studien Einsatz von Erythropoetin nicht erlaubt)
→ nur selten Anämie-bedingter Stopp von TVR: bei den Patienten unter TVR + Peg-IFN/RBV wurde in 4% TVR und in 1% TVR + Peg-IFN/RBV gestoppt
Interaktionen
- TVR = starker CYP3A4-Inhibitor (und gleichzeitig CYP3A4-Substrat)
→ keine gleichzeitige Gabe von:
- Alfuzosin (Xatral®, α1-Blocker, Prostatahyperplasie, CYP3A4-Substrat),
- Rifampicin (Rimactan®, Antibiotikum, starker CYP3A4-Inducer)
- HMG-CoA-Reduktatse-Inhibitoren (Atorvastatin (Sortis®), Lovastatin, Simvastatin (Zocor®), CYP3A4-Substrat) → empfohlene Alternativen: Pravastatin (Selipran®), Rosuvastatin (Crestor®)
- orales Midazolam (Dormicum®, Benzodiazepin, CYP3A4-Substrat → AUC (area under the curve) 3-9x↑)
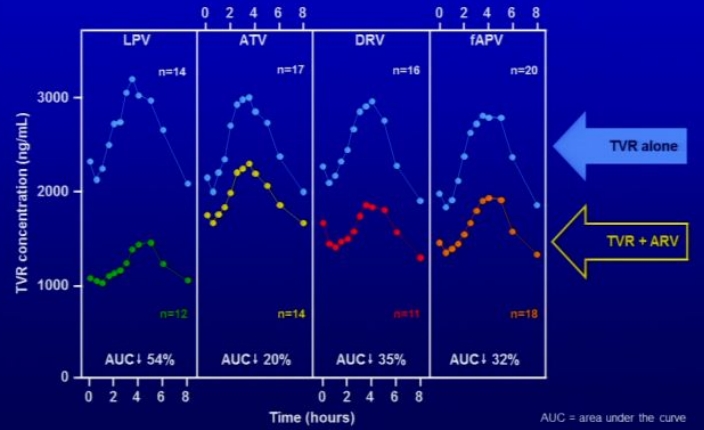
- Einfluss von HIV-Proteasehemmern (PI) auf die AUC von Telaprevir
- 2x tgl. Lopinavir/Ritonavir (LPV/r) (400/100mg): TVR 54%↓
- 1x tgl. Atazanavir/Ritonavir (ATV/r) (300/100mg): TVR 20%↓
- 2x tgl. Darunavir/Ritonavir (DRV/r, PI) (600/100mg): TVR 35%↓
- 2x tgl. Fosamprenavir/Ritonavir (fAPV/r) (700/100mg): TVR 32%↓
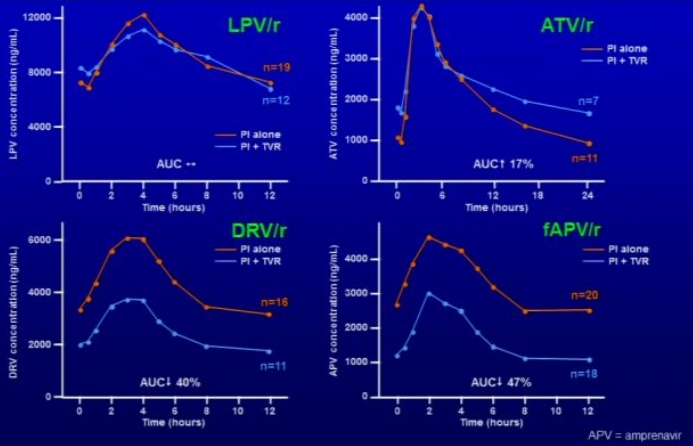
- Einfluss von Telaprevir auf die AUC von HIV-Proteasehemmern (PI)
- Lopinavir/Ritonavir (LPV/r) unbeeinflusst
- Atazanavir/Ritonavir (ATV/r) 17%↑
- Darunavir/Ritonavir (DRV/r) 40%↓ → ggf. vor HCV-Therapie ART-Umstellung
- Fosamprenavir/Ritonavir (fAPV/r) 47%↓ → ggf. vor HCV-Therapie ART-Umstellung
- gleichzeitige Gabe von 3x tgl. 750mg Telaprevir und 1x tgl. 600mg Efavirenz:
→ Telaprevir: AUC 20%↓, Tal-Spiegel 50%↓ →TPV höher dosieren: 3x tgl. 1125mg
- gleichzeitige Gabe von Telaprevir und Tenofovir:
→ Telaprevir: unbeeinflusst
→ Tenofovir: 30%↑
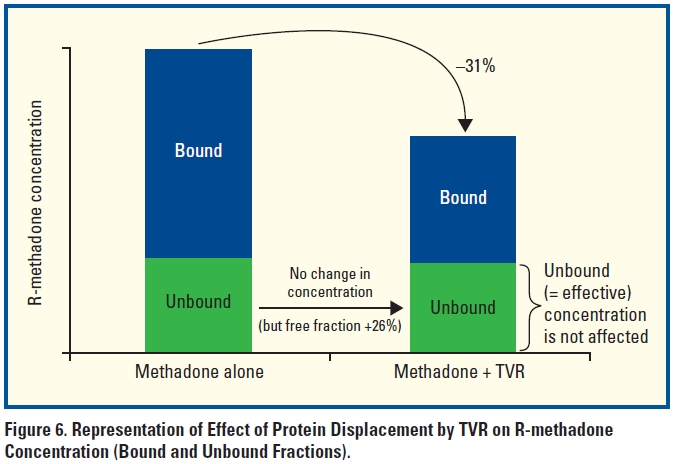
- gleichzeitige Einnahme von Telaprevir und Methadon:
→ Telaprevir: unbeeinflusst
→ Methadon: totale Methadon-Konzentration 30%↓, aber Menge des wirksamen freien (d.h. nicht Protein-gebundenen) Methadons unverändert → keine Entzugssymptome zu erwarten, keine Dosisanpassung nötig
Elimination
- vorwiegend hepatisch metabolisiert
- Ausscheidung zu 1% mit dem Urin und zu 82% mit dem Stuhl
Resistenzentwicklung
- ja, v.a. unter TVR-Monotherapie (deshalb nur in Kombination mit Peg-IFN/RBV!) bzw. bei eingeschränkter Peg-IFN/RBV-Wirksamkeit
- nach TVR-Stopp können Resistenzmutationen über die Zeit verschwinden, d.h. in der Resistenzprüfung nicht mehr nachweisbar sein (Rückmutation zum Wildtyp)
→ bislang unklar, ob die Resistenzmutationen im Falle einer HCV-Proteasehemmer-Reexposition (erneuter Selektionsdruck) wieder zu Tage treten - Cave: Kreuzresistenz zwischen Boceprevir und Telaprevir (Peg-IFN/RBV bleiben wirksam)
Preis
375mg-Tablette: 68,12 CHF
→ Tagesdosis (6 Tabletten): 408,75 CHF
→ Wochendosis: 2.861,24 CHF
→ 4 Wochen (Monat): 11.444,95 CHF (168 Tabletten)
→ 12 Wochen (maximale Therapiedauer): 34.334,85 CHF
Zulassung
FDA-Zulassung 23.05.2011 (noch keine Zulassung für HIV-Koinfizierte)
? Weitere Informationen unter „Zusatzinformationen Incivo„.
? Beachten Sie unseren Disclaimer