HIV-Übertragung bald durch HSV-2-Suppression vermeidbar?
Acyclovir konnte bei HIV- und HSV-2-positiven Frauen die HIV-RNA sowohl im Zervikalsekret als auch im Blut signifikant senken. Man erhofft sich davon nun eine verminderte HIV-Übertragungsrate in serodifferenten Paaren.
Es ist eine typische Eigenschaft der Herpesviren, nach der Erstinfektion im Körper im Sinne eine latenten Infektion zu überdauern. Dies trifft auch für das HSV-2 (Humanes Herpes-Virus 2), den typischen Erreger des Herpes genitalis zu. Entsprechend muss bei positiver HSV-2-Serologie immer wieder mit zum überwiegenden Teil asymptomatisch verlaufenden Reaktivierungen gerechnet werden. Es konnte gezeigt werden, dass dies mit einer verstärkten HIV-Replikation assoziiert ist (Rebbaprada et al., 2007; Nagot et al., 2008). Somit stellt sich die Frage, ob eine HSV-2-Suppressionstherapie bei HIV-HSV-2-Koinfizierten die Vermehrung des HI-Virus eindämmen und damit die Gefahr einer HIV-Übertragung auf den HIV-negativen Partner bzw. die HIV-negative Partnerin reduzieren kann.
Dunne et al. sind im Rahmen einer Studie an HIV-HSV-2-koinfizierten Frauen in Thailand dem ersten Teil dieser Frage nachgegangen. In einem verblindeten, randomisierten Crossover Trial wurden 67 HIV- und HSV-2-positive Frauen ohne antiretrovirale Therapie mit CD4-Zellzahl >200/ul und ohne opportunistische Infekte untersucht (mediane CD4-Zellzahl 366/ul (209-930/ul), mittleres Alter 33 Jahre (22-46 Jahre), 0-2 Geschlechtspartner im vergangenen Jahr, nur 42% hatten jemals einen symptomatischen Herpes genitalis). Neben Schwangerschaft und Stillen waren Niereninsuffizienz (Krea >1,4mg/dl bzw. >124umol/l) sowie ein pathologischer PAP-Abstrich Ausschlusskriterien. Wurde in der der Studienteilnahme vorausgehenden Screening-Visite eine Geschlechtskankheit diagnostiziert (Syphilis-Test, Zervikal-Abstrich auf Chlamydia, Gonorrhoe, Trichomoniasis, Candidiasis, bakterielle Vaginose), konnten die betreffenden Frauen 2 Wochen nach einer entsprechenden Behandlung eingeschlossen werden. Trat während der Studienteilnahme ein symptomatischer Herpes genitalis auf (Genitalulkus), erfolgte unter Aussetzen der Studienmedikation eine episodische Therapie mit 3x 400mg Acyclovir für 7 Tage. Die Analyse erfolgte als Intention-to-treat.
Die eine Hälfte der Studienteilnehmerinnen erhielt zunächst während eines Monats 2x 400mg Acyclovir p.o. und nach einer einmonatigen Wash-out-Phase (HWZ Acyclovir: 2,5h) während eines Monats Placebo (34/34 komplettierten die Studie). Bei den anderen 33 Studienteilnehmerinnen war der zeitliche Ablauf genau umgekehrt, d.h. je 1 Monat Placebo, Wash-out-Phase und Acyclovir (28/33 komplettierten die Studie; sämtliche drop-outs vor der Acyclovir-Phase: 2x Wegzug, 1x Beginn HAART, 1x Schwangerschaft, 1x Hospitalisation wegen Tuberkulose). Als Acyclovir-Nebenwirkung bekannte Symptome wie Kopfschmerzen, Übelkeit und Diarrhoe traten unter Acyclovir und Placebo gleich häufig auf. Die Compliance mit der Studienmedikation (gemessen mit Pill-Count, Tagebuch und Medication Event Monitoring System (MEMS)) lag sowohl für die Acyclovir- als auch die Placebo-Phase bei ca. 97%.
Dem Umstand, dass die HIV-RNA im Genitalsekret grösseren Schwankungen unterliegt als im Blut wurde insofern Rechnung getragen, als dass die Plasma-HIV-RNA monatlich und die HIV-RNA im Zervikalsekret wöchentlich bestimmt wurde (für die Analyse Verwendung von monatlichen Durchschnittswerten).
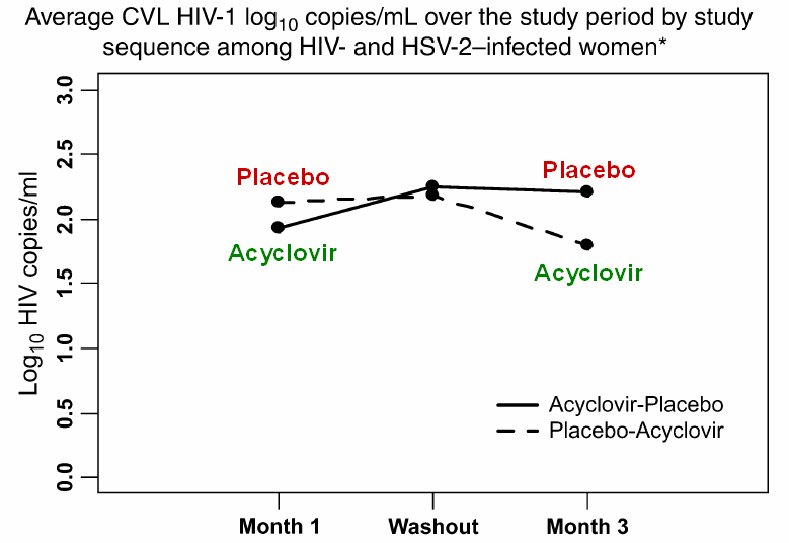
Zu Studienbeginn hatten 75% der Frauen einen positiven HIV-RNA-Nachweis im Zervikalsekret (Detektionsgrenze: 40 Kopien/ml). Die mittlere Viruslast betrug im Plasma 4,6 (2,9-5,7) log Kop./ml und im Zervikalsekret 1,9 (0-4,1) log Kop./ml. Der Anteil Frauen, bei welchen mindestens einmal HIV-RNA im Zervikalsekret nachgewiesen wurde, war in den Acyclovir-Monaten mit 64,5% deutlich niedriger als in den Placebo-Monaten mit 80,3% (p<0,01). Der Anteil Frauen mit nachweisbarer HSV-2-DNA im Zervikalsekret wurde unter Acyclovir ebenfalls signifikant gesenkt (von 42,4% auf 1,6%). In den Acyclovir-Monaten lag die HIV-RNA im Zervikalsekret im Schnitt um 0,3 log Kop./ml und im Blut um 0,47 log Kop./ml tiefer als in den Placebo-Monaten (1,9 vs 2,2 Kop./ml, p<0,0001 bzw. 3,78 vs 4,26 Kop./ml, p). Dieser Unterschied blieb auch nach Korrektur bezüglich Geschlechtskrankheiten, Baseline-Werten für HSV-2 und HIV im Zervikalsekret, Plasma-HIV-RNA, CD4-Zellzahl, Studienabfolge und Mens signifikant. Bei 3 Studienteilnemerinnen erfolgte im Verlauf eine 7tägige Acyclovir-Therapie mit 3x 400mg, wobei die jeweilige Studienphase nicht angegeben wurde.
Weitere kürzlich publizierte Studien weisen in die gleiche Richtung. Eine Suppressionstherapie mit Valacyclovir (bessere orale Bioverfügbarkeit als Acyclovir (55 vs 10-20%), aber bedeutend teurer) führte bei HIV/HSV-2-koinfizierten Männern zu einer Reduktion der rektalen und Plasma-HIV-RNA (Zuckermann et al., 2007) sowie bei HIV/HSV-2-koinfizierten Frauen zu einer Senkung der HIV-RNA in Genitalsekret und Plasma (Nagot et al., 2007).
Die Höhe der HIV-RNA ist nur ein Surrogat-Marker für die Infektiösität (Quinn et al., 2000). Ob die durch eine HSV-2-Suppressionstherapie erzielte absolute Reduktion der HIV-RNA in Plasma bzw. Genitalsekret oder der verminderte Anteil jener mit nachweisbarer HIV-RNA im Genitalsekret letztlich in einer verminderten HIV-Übertragungsrate resultiert, muss direkt untersucht werden und ist Gegenstand aktueller Studien (Link). Demgegenüber hat sich die Hoffnung, dass eine HSV-2-Suppressiontherapie bei HSV-2-Positiven die Empfänglichkeit für eine HIV-Infektion verringern könnte, unterdessen wieder zerschlagen (Celum et al., 2008; Watson-Jones et al., 2008).
Sollte sich die These einer verminderten HIV-Übertragungsrate unter HSV-2-Suppressionstherapie bei HIV-HSV-2-Koinfizierten bestätigen, wirft das einige Fragen auf:
1) Soll der HSV-2-Serostatus standardmässig bei allen HIV-Positiven bestimmt werden?
2) Die vorliegende Studie hat gezeigt, dass der Effekt auf die HIV-RNA nur während der regelmässigen Einnahme der HSV-2-Suppressiontherapie zu beobachten ist. Folglich wäre eine Dauertherapie nötig. Stellt sich – nicht zuletzt vor dem Hintergrund, dass 58% der HSV-2-Positiven noch nie eine Herpes genitalis-Symptomatik hatten – die Frage nach der Compliance. Diese war zwar in der Beobachtungsperiode mit 97% hervorragend, doch die Langzeitcompliance dürfte bei symptomlosen Personen deutlich tiefer liegen.
3) Die Number-needed-to-prevent wird Auskunft darüber geben, ob es sinnvoll ist, sämtliche HIV-HSV-2-Koinfizierte einer HSV-2-Suppressionstherapie zuzuführen oder zum Beispiel nur jene, bei denen HIV-RNA im Genitalsekret nachweisbar ist und welche tatsächlich mit einer verminderten Viruslast ansprechen. Dies dürfte letztlich eine Kosten-Nutzen-Frage sein und ein Abwägen gegenüber anderen Methoden der Prävention einer HIV-Übertragung wie Kondom und HAART.