Übertragung von resistenten Viren
Während wir in der Schweiz und in Europa seit Jahren eher eine Abnahme der Übertragung von resistenten Viren (TDR) 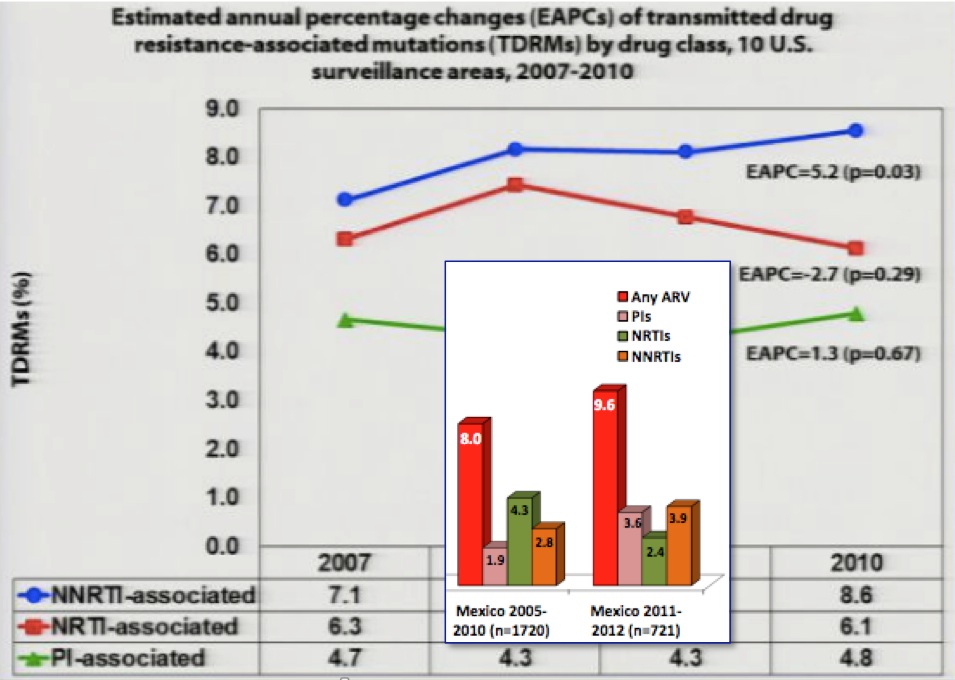 beobachten, ist der Trend aus den USA eher bedenklich. Vom CDC wurden die US-Daten präsentiert (Abstr 149). In den USA zeigt sich eine signifikante Zunahme der NNRTI-Resistenz in den Jahren 2007 bis 2010. Dieser Trend ist bedenklich, insbesondere im Vergleich zu Mexiko (kleine eingefügte Grafik in nebenstehender Abb.), wo zwar auch ein leichter Anstieg zu beobachten ist, die TDR-Rate jedoch gerade etwa die Hälfte darstellt (Abstr 617). Die Resultate aus Spanien waren ähnlich tief (3.5% NNRTI/RTI, 1.8% PI) und ohne zunehmenden Trend über die Jahre (Abstr 619).
beobachten, ist der Trend aus den USA eher bedenklich. Vom CDC wurden die US-Daten präsentiert (Abstr 149). In den USA zeigt sich eine signifikante Zunahme der NNRTI-Resistenz in den Jahren 2007 bis 2010. Dieser Trend ist bedenklich, insbesondere im Vergleich zu Mexiko (kleine eingefügte Grafik in nebenstehender Abb.), wo zwar auch ein leichter Anstieg zu beobachten ist, die TDR-Rate jedoch gerade etwa die Hälfte darstellt (Abstr 617). Die Resultate aus Spanien waren ähnlich tief (3.5% NNRTI/RTI, 1.8% PI) und ohne zunehmenden Trend über die Jahre (Abstr 619).
Am Anfang war das « Founder Virus»
In dieser Poster-Session wurden verschiedene Aspekte zum sogenannten “bottleneck” beschrieben. Tatsächlich wissen wir schon länger, dass bei der HIV-Übertragung in den meisten Fällen (95%) nur ein Virus übertragen wird. Dieses Virus, auch „Transmitted/Founder-Virus“ (T/F) genannt, unterscheidet sich meist vom Virus, das in der chronischen Infektion gefunden wird. Wir wissen schon sehr lange, dass das T/F-Virus an seiner Oberfläche (gp120, V-loops) weniger Aminosäuren mit Zuckerresten (glycosylated AS) hat. Alle hier präsentierten Arbeiten haben weitere, besondere Eigenschaften dieses T/F-Virus untersucht.
Übertragung über Muttermilch – Selektion, wie bei sexueller Übertragung
Eine spezielle Situation ist bei der Übertragung durch Muttermilch gegeben. Kyle Nakamura (Abstr 246) aus Los Angeles hat Fälle von HIV-Übertragung (Clade C) von der stillenden Mutter auf das Kind untersucht. Die Autoren haben auch hier Unterschiede bei den Viren von Mutter und Kind untersucht. Sie interessierten sich für zwei Eigenschaften: Glykosylierung der Viren und Empfindlichkeit für neutralisierende Antikörper. In der chronischen Infektion müssen Viren naturgemäss resistenter gegenüber neutralisierenden AK sein. 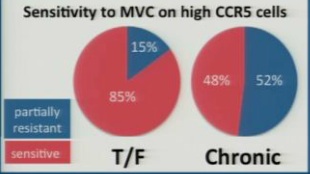
Bei der Untersuchung dieser Viren wurden zwei Regionen des gp120 Glykoproteins angeschaut: V2 und V3. Die Autoren haben schön gezeigt, dass die Unterschiede zwischen Mutter- und Kind-Varianten vor allem im V2-Loop von pg120 liegen. Die kindlichen Viren waren an diesem Ort weniger glykosyliert und weniger empfindlich auf Neutralisierung. Diese Beobachtung passt gut zu unserem Verständnis der Resistenz gegenüber Neutralisierung. Durch die Glykosylierung an der V2-Stelle schützt das Virus die zentrale Stelle, an der neutralisierende Antikörper binden würden. Doch diese Stelle ist offenbar wichtig für die Übertragung, denn hier bindet das CD4-Molekül der Zielzelle.
Transmission nur durch CCR5-Varianten
Dass bei der sexuellen Übertragung praktisch nur R5-Varianten des Virus übertragen werden (der Phänotyp, der den CCR5-Corezeptor benutzt) wissen wir schon länger. Zahra Parker (Abstr 247) hat gezeigt, dass V/T-Virus trotz CCR5 Phänotyp (sowohl Clade B und Clade C) deutlich abhängiger ist von der Verfügbarkeit von CCR5-Rezeptoren auf der Zelle als das Virus, das von chronisch infizierten Personen verwendet wurde.
Auch CD4-Rezeptorendichte entscheidend für die Transmission
Eine ähnliche Aussage findet sich im Poster von K. Chikere (Abstr 248) für den CD4-Rezeptor. Die Gruppe aus LA präsentierte eine interessante Untersuchung mit dem sog. Affinafile-System. Bei diesem System werden Zellen mit unterschiedlicher CD4- und CCR5-Dichte mit HIV infiziert und die Effizienz der Infektion gemessen. Es zeigte sich, dass T/F-Virusstämme sich deutlich von Viren chronisch Infizierter unterscheiden. T/F Viren brauchen zur Übertragung deutlich höhere CD4-Dichten als chronische Viren.
Das geschickte Lavieren des HI-Virus
Alle diese Arbeiten bestätigen eigentlich, was sich in den letzten Jahren immer deutlicher abzeichnet und wie folgt vereinfacht werden kann: während der chronischen Infektion im Körper benutzt das Virus vorwiegend den direkten Weg von Zelle zu Zelle, um sich fortzupflanzen. Dabei können ihm die neutralisierenden Antikörper wenig antun. Seine Achillesferse, die Bindungsstelle mit dem CD4-Molekül, deckt es dabei geschickt mit Zuckerresten ab. Doch bei der Übertragung auf einen anderen Menschen scheint alles anders. Hier kann das Virus nur „von aussen“ eindringen. Für diese Aufgabe muss es sich an das CD4-Molekül der T-Zelle binden können. Daher ist es darauf angewiesen, dass seine Achillesferse, die Bindungsstelle auf dem gp120 nicht von den variablen Zuckerresten der V2-Schlinge verdeckt wird. Denn nur so kann die Zielzelle erkannt und erobert werden. Dabei kommt es dem Virus entgegen, wenn die Zielzelle eine hohe Dichte an CD4-Molekülen an der Oberfläche aufweist. Und zu guter Letzt ist das Virus in diesem Stadium für den Eintritt in die Zelle auch auf die CCR5-Rezeptoren auf der Zelle angewiesen. Eine Eigenschaft, die in späteren Phasen weniger relevant ist.
Vieles spricht also dafür, dass die Voraussetzungen an der Oberfläche des Virus in der Situation der Transmission und der chronischen Infektion unterschiedlich sind. Wie genau sich das Virus dann später ausbreitet und weshalb diese Replikation immer noch durch CCR-5-Antagonisten blockiert wird, verstehe ich, offen gesagt, nicht. Ein Grund mehr, weitere Kongresse zu besuchen, reell oder virtuell…..
