Zusatzinformation Incivo (Telaprevir)
Hier finden Sie Zusatzinformatonen über INCIVO (Telaprevir)
ADVANCE-Studie (Peg-IFN = Peg-IFN α-2a)
- 1’088 HCV-monoinfizierte, therapie-naive Patienten mit HCV-Genotyp 1
3 Therapiearme ohne vorgängige Lead-in-Phase:
- TVR + Peg-IFN/RBV für 8 Wochen
⇒ HCV-RNA bei Woche 4 bereits negativ → weitere 16 Wochen Peg-IFN/RBV allein (Gesamttherapiedauer: 24 Wochen)
⇒ HCV-RNA bei Woche 4 noch nachweisbar → weitere 40 Wochen Peg-IFN/RBV allein (Gesamttherapiedauer: 48 Wochen) - TVR + Peg-IFN/RBV für 12 Wochen
⇒ HCV-RNA bei Woche 4 bereits negativ → weitere 12 Wochen Peg-IFN/RBV allein (Gesamttherapiedauer: 24 Wochen)
⇒ HCV-RNA bei Woche 4 noch nachweisbar → weitere 36 Wochen Peg-IFN/RBV allein (Gesamttherapiedauer: 48 Wochen) - Peg-IFN/RBV für 48 Wochen (Kontroll-Gruppe)
- SVR-Raten: 69% in der 8-Wochen- und 75% in der 12-Wochen-Telaprevir-Gruppe versus 44% in der Kontrollgruppe
- insgesamt 58% der Patienten mit Telaprevir bereits nach 4 Wochen HCV-RNA-negativ
-> Therapieverkürzung auf total 24 Wochen
ILLUMINATE-Studie (Peg-IFN = Peg-IFN α-2a)
- 322 HCV-monoinfizierte, therapie-naive Patienten mit HCV-Genotyp 1 und nach 4 Wochen TVR+ Peg-IFN/RBV nicht mehr nachweisbarer HCV-RNA
→ nach 12 Wochen TVR + Peg-IFN/RBV:
A) weitere 12 Wochen Peg-IFN/RBV allein (Gesamttherapiedauer: 24 Wochen) → SVR: 92%
B) weitere 36 Wochen Peg-IFN/RBV allein (Gesamttherapiedauer: 48 Wochen) → SVR: 88%
→ somit 24 Wochen-Regime in dieser Patientengruppe nicht unterlegen
REALIZE-Studie (Peg-IFN = Peg-IFN α-2a)
- 662 HCV-monoinfizierte Patienten mit HCV-Genotyp 1 und früherem Therapieversagen (d.h. Relapse, partielles Ansprechen oder Null-Response) unter Peg-IFN/RBV
→ jeweils 48 Wochen Therapie:
A) TVR + Peg-IFN/RBV für 12 Wochen, gefolgt von 36 Wochen Peg-IFN/RBV allein
B) Peg-IFN/RBV-Lead-in für 4 Wochen, gefolgt von 12 Wochen TVR + Peg-IFN/RBV, gefolgt von 32 Wochen Peg-IFN/RBV allein
C) Peg-IFN/RBV für 48 Wochen (Kontroll-Gruppe)
- SVR-Raten in den beiden TVR-Gruppen vergleichbar: 64% und 66% (→ somit Lead-in-Phase ohne Benefit) und signifikant höher als in der Kontroll-Gruppe (17%)
- SVR-Raten in den TVR-Gruppen: 86% bei früherem Relapse, 57% bei früherem partiellen Ansprechen und 31% bei früheren Non-Respondern (<2 log U/ml HCV-RNA-Abfall nach 12 Wochen)
IL28B
- unabhängig vom IL28B-Genotyp höhere SVR-Raten mit TVR + Peg-IFN/RBV als mit Peg-IFN/RBV allein
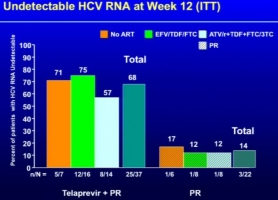
HIV-Koinfizierte (Interimsanalyse) (Peg-IFN = Peg-IFN α-2a)
- 60 HCV-therapienaive HIV-HCV-Koinfizierten mit Genotyp 1:
⇒ 20 Patienten ohne ART (CD4≥500/ul, HIV-RNA≤100.000 Kop/ml)
⇒ 40 Patienten mit ART (d.h. FTC+TDF+EFV oder FTC bzw. 3TC+TDF+ATV/r; CD4≥300/ul, HIV-RNA≤50 Kop/ml)
A) 12 Wochen TVR + Peg-IFN/RBV → weitere 36 Wochen Peg-IFN/RBV allein (Gesamttherapiedauer: 48 Wochen)
B) 48 Wochen Peg-IFN/RBV (Kontroll-Gruppe)
(Telaprevir 3x 750mg mit ATV/r bzw. 3x tgl. 1125mg mit EFV)
- nach 4 Wochen HCV-RNA negativ: 70% (26/37) der mit TVR behandelten Patienten versus 5% (1/22) in der Kontroll-Gruppe
- nach 12 Wochen HCV-RNA negativ: 68% der mit TVR behandelten Patienten versus 14% in der Kontroll-Gruppe
- HCV-Therapieansprechen mit Atazanavir/Ritonavir (57%) etwas geringer als mit Efavirenz (75%) oder ohne ART (71%). (Die geringen Fallzahlen lassen diesbezüglich jedoch noch keine definitive Aussage zu.)
- mediane Telaprevir-Talspiegel mit und ohne ART ähnlich
- mediane ART-Talspiegel (Atazanavir, Tenofovir, Efavirenz) unter gleichzeitiger Telaprevir-Gabe um weniger als 20% verändert
Zu erwartender Therapieerfolg
HCV-Genotyp 1: 40-50% mit Peg-IFN/RBV (>70% mit BOC oder TVR + Peg-IFN/RBV)
HCV-Genotyp 2/3: 80% mit Peg-IFN/RBV
HCV-Genotyp 4: 60-70% mit Peg-IFN/RBV
⇒ vgl. auch Schemata bzgl. Therapiedauer
HIV-Koinfizierte
- höhere SVR-Rate, wenn relative CD4-Zellzahl >25%
- im Allgemeinen 10-15% schlechteres HCV-Therapieansprechen als HCV-Monoinfizierte
Nach erfolgloser HCV-Therapie
Faktoren, die das Therapieansprechen negativ beeinflussen:
- Alter >40 Jahre
- bereits fortgeschrittene Fibrose/Zirrhose
- hohe Ausgangs-Viruslast (>400.000 U/ml bzw. >800.000 U/ml)
- Insulinresistenz
- BMI >25
- HIV-Koinfektion
Kontraindikationen Peg-IFN/RBV
- Dekompensierte Leberzirrhose
- Autoimmunerkrankungen
- Unkontrollierte Depression/Psychose
- Unkontrollierte Epilepsie
- Schwere Anämie, Leuko- oder Thrombozytopenie¨
- Schwere kardiopulmonale Erkrankung
- Schwangerschaft (oder unzureichende Kontrazeption), Stillzeit
Nicht-Kontraindikationen Peg-IFN/RBV
- HIV-Koinfektion
- Methadon-/Heroinsubstitution
- moderater Alkohol- und Drogenkonsum, welcher die Adhärenz nicht gefährdet
Opiatsubstitutionsprogramme (Methadon, Heroin) haben sich für die HCV-Behandlung als geeignetes Setting erwiesen, u.a. wegen der Möglichkeit einer DOT (directly observed therapy). Adhärenz, Nebenwirkungen und Therapieansprechen sind bei i.v.-Drogenkonsumenten unter Opioidsubstitution und Nichtdrogenabhängigen vergleichbar. Das Reinfektionsrisiko ist gering.
Eine absolute Karenz bzgl. Alkohol und Drogen ist während der HCV-Therapie zwar wünschenswert, aber nicht obligat, solange die Adhärenz nicht gefährdet ist.
Nebenwirkungsmanagement (Peg-IFN/RBV)
Schrittweise Dosisreduktion Peg-IFN/RBV
- Peg-IFN α-2a: 180→135→90μg/Woche
- Peg-IFN α-2b: 1,5→1,0→0,5 μg/kg/Woche
Therapiedauer (response-guided therapy, stopping rules)
Die folgenden Therapiealgorithmen beziehen sich auf eine Therapie mit Peg-IFN/RBV bei chronischer Hepatitis C
⇒ bezüglich Therapiedauer bei Einsatz der HCV-Proteasehemmer Boceprevir (BOC) und Telaprevir (TVR) siehe unter Victrelis® (BOC) bzw. Incivo® (TVR)
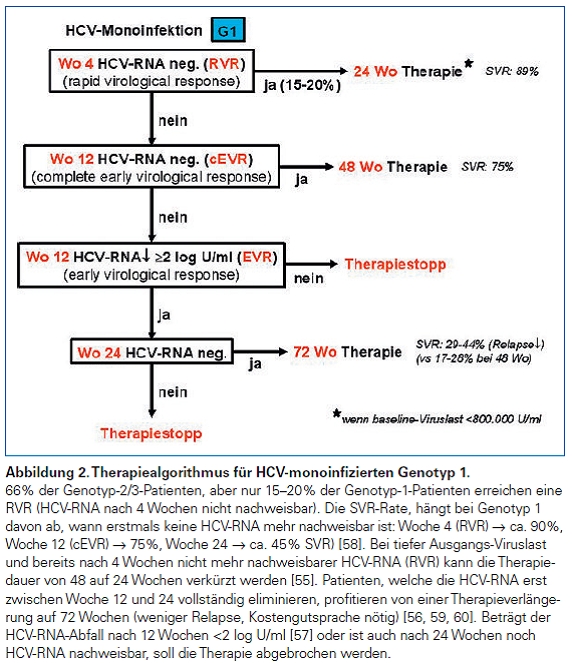
HCV-Monoinifzierte Genotyp 1
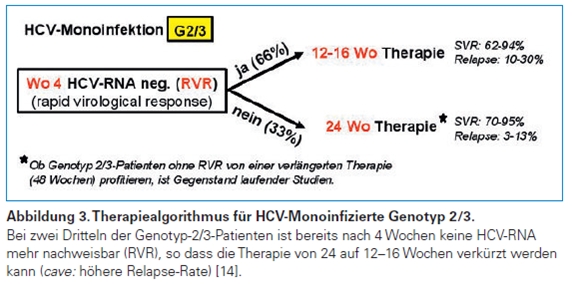
HCV-Monoinfizierte Genotyp 2/3
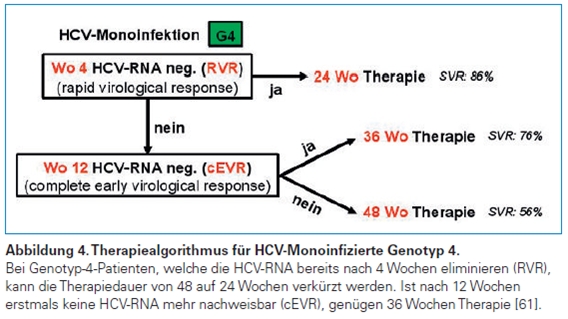
HCV-Monoinfizierte Genotyp 4
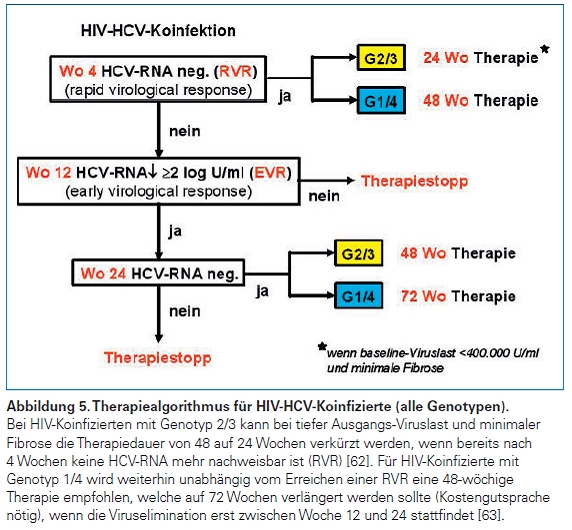
HIV-HCV-Koinfizierte (alle Genotypen)
Quellen
- www.documed.ch
- EASL Clinical Practice Guidelines: Management of hepatitis C virus infection. European Association for the Study of the Liver. Journal of Hepatology 2011;55:245-264
- Witteck A. und Schmid P. Hepatitis C – Update 2010. Schweiz Med Forum 2010;10(42):729-736
- Journal Watch HIV/AIDS Clinical Care May 27, 2011
? Beachten Sie unseren Disclaimer.