Anidulafungin – neues Echinocandin für invasive Candidiasis, ist Fluconazol out?
In einer randomisierten, doppelblinden, auf Noninferiorität angelegten Multicenter-Studie wurde das neue Echinocandin Anidulafungin mit Fluconazol in der Behandlung der Candidämie und anderer Formen der invasiven Candidiasis verglichen.
Über 3 Jahrzehnte war Amphotericin B-Deoxycholat (Ergosterol-Synthese-Hemmer, fungizid) die Standard-Therapie für invasive Pilzinfektionen. Schlechte Verträglichkeit, Infusions-assoziierte Akut-Reaktionen und Nephrotoxizität führten häufig zum vorzeitigen Therapieabbruch. In den späten 70er und 80er Jahren erschien mit den ebenfalls die Zellmembran-Synthese von Pilzen hemmenden Azolen (zunächst Miconazol und Ketoconazol, dann Fluconazol und Itraconazol), eine neue Klasse antifungaler Medikamente, welche eine Alternative zum Amphotericin B-Deoxycholat bot. Seit ein paar Jahren gibt es für invasive Pilzinfektionen weitere therapeutische Optionen: Lipidformulierungen von Amphotericin B (Kolloid-Dispersion, Lipid-Komplex und liposomal), neue Azole (Voriconazol und Posaconazol) und Echinocandine (Caspofungin, Micafungin und Anidulafungin).
Echinocandine, welche nur parenteral verabreicht werden können, wirken über eine Hemmung der Glucan-Synthetase (Enzym für die Synthese des beta-(1,3)-D-Glucans der Pilz-Zellwand) in vitro bakterizid, Azole dagegen nur fungistatisch. Zwar sind Echinocandine untereinander kreuzresistent, es besteht jedoch keine Kreuzresistenz gegenüber Azolen. C. glabrata (häufigste non-albicans Species) ist dosisabhängig sensibel, C. krusei hingegen intrinsisch resistent gegenüber Fluconazol. Demgegenüber sind Echinocandine sowohl gegen C. glabrata als auch krusei wirksam. Der zunehmende Einsatz von Fluconazol in Prophylaxe und Therapie bei Hochrisikopatienten lässt eine Zunahme der Infektionen durch non-albicans Candida species befürchten.
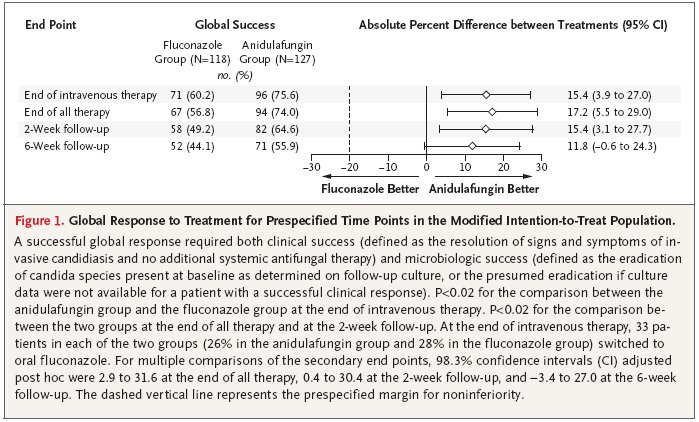
245 Patienten mit invasiver Candidiasis (89% davon nur mit Candidämie, 97% Nicht-Neutropeniker) wurden während 10 Tagen entweder mit Anidulafungin i.v. (200mg an Tag 1, dann 100mg tgl.) oder Fluconazol i.v. (800mg an Tag 1, dann 400mg tgl.) behandelt. Anschliessend konnten alle Patienten auf Fluconazol p.o. (400mg tgl.) umgestellt werden. Primärer Endpunkt war das globale Ansprechen (klinisch und mikrobiologisch) am Ende der intravenösen Therapie. Dieser wurde in der Anidulafungin-Gruppe in 75,6% und in der Fluconazol-Gruppe in 60,2% erreicht (Unterschied von 15,4%; 95%-CI 3,9-27,0). Wurde in der Analyse von den insgesamt 47 teilnehmenden Centern das mit den meisten eingeschlossenen Patienten (25 Pat. = 10%) eliminiert, lag der Unterschied nur noch bei 12,1% (73,2% bei Anidulafungin versus 61,1% bei Fluconazol, 95%-CI -1,1-25,3). Danach war Anidulafungin zwar weiterhin Fluconazol nicht unterlegen, allerdings nicht mehr signifikant besser. Häufigkeit und Art der Nebenwirkungen waren in beiden Gruppen ähnlich (Leberwerterhöhung etwas häufiger in der Fluconazol-Gruppe: 7,2 vs. 1,5%, p=0,03). Die Gesamtmortalität zeigte keinen signifikanten Unterschied: 31% in der Fluconazol-Gruppe versus 23% in der Anidulafungin-Gruppe (p = 0,13). N Engl J Med 2007;356:2472-82
Wesentliche Ausschlusskriterien der Studie waren: prophylaktische Azol-Behandlung von mehr als 1 Woche innerhalb von 30 Tagen vor Einschluss, refraktäre Candida-Infektion, Candida krusei-Infektion sowie Candida-Osteomyelitis, -Endokarditis oder -Meningitis. Die Entfernung des zentralvenösen Katheters wurde bei allen Patienten mit Candidämie empfohlen (Biofilm-Bildung). Die antifungale Therapie wurde für 14 Tage über die Negativierung der Blutkulturen und das klinische Ansprechen hinaus fortgesetzt (Therapiedauer 14-42d). Kriterien für die Umstellung auf eine perorale Therapie waren: orale Medikation möglich, mindestens 24h afebril, letzte Blutkultur negativ, klinische Besserung. Das Follow-up reichte bis 6 Wochen nach Beendigung der antifungalen Therapie. Die Auswertung erfolgte im Sinne einer Intention-to-treat-Analyse (d.h. auch unklares Ansprechen, "loss to follow-up" oder nicht Candidiasis-bedingter Tod wurden als Therapieversagen gewertet).
Die Verteilung der Candida-Species war in der Anidulafungin- und der Fluconazol-Gruppe nicht signifikant verschieden (C. albicans: 64 vs.59% (p=0,51), C. glabrata: 16 vs. 25% (p=0,08), C. parapsilosis: 10 vs. 14% (p=0,44), C. tropicalis: 12 vs. 9% (p=0,54), andere: 5 vs 3% (p=0,50)). Mit Ausnahme von nur 10 C. albicans bzw. glabrata-Isolaten (je 5 in der Anidulafungin- und der Fluconazol-Gruppe), lag die MHK für Fluconazol bei allen 242 Candida Species-Isolaten (95,5%) bei <16ug/ml. Eine Korrelation zwischen der MHK für Fluconazol und der Eradikationsrate fand sich nicht. Sämtliche Isolate waren Anidulafungin-sensibel, wobei die MHK für C. parapsilosis vergleichsweise höher ausfiel, was in einer geringeren Eradikationsrate resultierte. Für alle Candida Species ausser C. parapsilosis war das globale Ansprechen am Ende der intravenösen Therapie in der Anidulafungin-Gruppe höher als in der Fluconazol-Gruppe (alle Candida Species: 77 vs. 61% (p=0,01), C. albicans: 81 vs 62% (p=0,02), C. glabrata: 56 vs. 50% (p=0,75), C. parapsilosis: 64 vs. 83% (p=0,37)). Am Ende der i.v.-Therapie wurde bei 8 Patienten (6,3%) in der Anidulafungin- und bei 17 Patienten (14,4%) in der Fluconazolgruppe eine persistierende Infektion dokumentiert (p=0,06; bei allen ausser 1 in der Fluconazol-Gruppe Katheter entfernt).
Eine mögliche Erklärung für das bessere globale Ansprechen in der Anidulafungin-Gruppe könnte die fungizide Wirkung des Echinocandins sein, wohingegen Fluconazol nur bakteriostatisch wirkt. In post hoc-Analysen zeigte sich an Tag 3 und 7 in der Anidulafungin-Gruppe im Vergleich zur Fluconazol-Gruppe zwar ein grösserer Anteil von Patienten mit negativen Blutkulturen. Die Unterschiede erreichten jedoch keine Signifikanz.
Zusammenfassend hat die Pharma-gesponserte Studie gezeigt, dass das neue Echinocandin Anidulafungin in der primären Therapie der candidämischen Form der invasiven Candidiasis bei Nicht-Neutropenikern gegenüber Fluconazol nicht unterlegen, möglicherweise sogar überlegen ist – bei einem mit Fluconazol vergleichbarem Sicherheitsprofil. Wo das neue Medikament seinen Platz finden wird, hängt sicherlich nicht zuletzt vom Preis ab. Bei zu erwartender vergleichbarer Wirksamkeit wird angesichts des ähnlichen Sicherheitsprofil aus Kostengründen Fluconazol weiterhin zu bevorzugen sein. Basierend auf pharmakokinetischen Überlegungen sind Azole in bestimmten klinischen Situationen (z.B. Meningitis, Endophthalmitis und Candidurie) möglicherweise sogar effektiver als Echinocandine. Bei kritisch kranken Patienten mit hämodynamischer Instabilität und Candidämie ist jedoch – vor allem bei vorgängiger Azol-Exposition – ein Echinocandin Mittel der 1. Wahl. Je nach Antibiogramm kann bei Umstellung auf p.o. wieder ein orales Azol eingesetzt werden. Fluconazol ist also keineswegs out.
Die im Swiss Medical Weekly 2006;136:447-463 publizierten Guidelines der FUNGINOS (Fungal Infection Network of Switzerland)-Gesellschaft empfehlen für die Behandlung von Patienten mit invasiver Candidiasis in der Schweiz folgendes:
Empirische Therapie bei Candidämie:
- Nicht-Neutropenikern ohne schwere Sepsis oder septischen Schock und ohne kürzliche Azol-Exposition => Fluconazol
- Patienten mit vorausgehender Azol-Behandlung => Amphotericin B-Deoxycholat oder Caspofungin
- Neutropeniker => Amphotericin B-Deoxycholat
- schwere Sepsis oder septischer Schock => Caspofungin
Erregerspezifische Therapie bei Candidämie:
- C. albicans, C. tropicalis oder C. parapsilosis => Fluconazol
- C. glabrata oder C. krusei => Caspofungin oder Amphotericin B-Deoxycholat
Bemerkung: Wenn man Echinocandine als therapeutisch äquivalent betrachtet (Datenlage spärlich), kämen für Anidulafungin die gleichen Indikationen wie für Caspofungin in Frage.
Weitere Literatur und Links:
Bennett JE. Echinocandins for Candidemia in Adults without Neutropenia. N Engl J Med 2006;355:1154-9