Zusatzinformation Raltegravir (MK-0518)
Raltegravir (RGV) ist der erste marktreife Hemmer der HIV-Intergrase der von Merck entwickelt wurde. Die Substanz wurde von der FDA am 12.10.07 registriert. In der Schweiz seit 1.5.08 zugelassen und kassenpflichtig, seit 1.5.10 auch für die Erstbehandlung zugelassen.
Wirksamkeit / Dosierung:
Eine Dosisfindungsstudie wurde bei 203 bisher unbehandelten Patienten mit Dosen von 100mg bid bis 600mg bid durchgeführt (s. ClinCareOptions). Alle Patienten erhielten zusätzlich TDF und 3TC und eine Gruppe wurde mit Efavirenz behandelt. Alle RGV-behandelten Patienten zeigten bereits in der Interim-Analyse nach 24 Wochen einen deutlicheren Abfall der Viruslast als unter EFV. Diese überaus hohe Potenz der neuen Substanz hat alle Erwartungen übertroffen.
Interaktionen: Eine Tabelle (als pdf) mit Interaktionen ist verfügbar auf www.HIV-druginteractions.org.
Kombination mit Pravastatin möglich
Van Luin et al. untersuchten die Kombination von RAL 400 mg BID und Pravastatin 40 mg QD an 24 gesunden Probanden. Nach 4 Tagen wurde bei Patienten unter dieser Kombination der gleiche mittlere LDL-Abfall gefunden wie bei Patienten mit Pravastatin allein. Die Pra vastatin-Spiegel sanken minimal um 4 %. Bei RAL sank die Cmin um 41 % und AUC stieg um 13 %. Da PK/PD-Daten aus Phase II/III Studien darauf hindeuten, dass die AUC und nicht Cmin als pharmakokinetischer Parameter für die Wirksamkeit von RAL maßgeblich ist, ist die Kombination ohne Dosisanpassung möglich (11. Intl Workshop Clin Pharm HIV Therapy, Sorrento, April 2010).
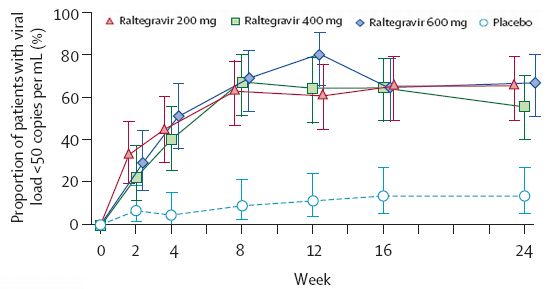
Bei vorbehandelten und therapieresistenten Patienten (Grinsztejn, Lancet 2007) fand sich ein geradezu phänomenales Ergebnis. Die Patienten wurden in drei Gruppen mit mit 200, 400 oder 600mg bid RGV behandelt und mit einer vierten Gruppe welche nur Plazebo zur optimierten Backgroundtherapie erhielt, vergliechen. Wie sich aus der nebenstehenden Grafik ableiten lässt, fanden sich praktisch bei allen Dosen eine fast ebenbürtige Suppression der Viruslast. Auch in dieser Studie zeigte sich ein Abfall um 2 log innert 2 Wochen. Selbst bei diesen schwierig zu behandelnden Patienten kam es noch in gut 60% zu einer vollständigen Suppression der Viruslast (s. Abbildung unten). Weniger als ein Dritte der Patienten hatten zusätzlich T-20. In Kombination mit RGV hatten diese in praktisch 100% eine Suppression < 400 (vgl. mit etwa 30% mit T-20 alleine).
Bei zuvor unbehandelten ("drug-naive") Patienten wurde die Substanz ebenfalls in einer 48-Wochen Dosisfindungsstudie evaluiert (Markovitz, JAIDS, 1.10.07). Auch in dieser Studie (Studie Merck 004) war die 400mg bid Dosis optimal (s. Abb unten). Die Wirksamkeit in der Kombination mit TDF+3TC gegenüber Efavirenz war insbesondere in den ersten Wochen überlegen und hielt auch bis 48 Wochen an. Die Substanz war besser verträglich als EFV und zeigte keinen Effekt auf Lipdiwerte.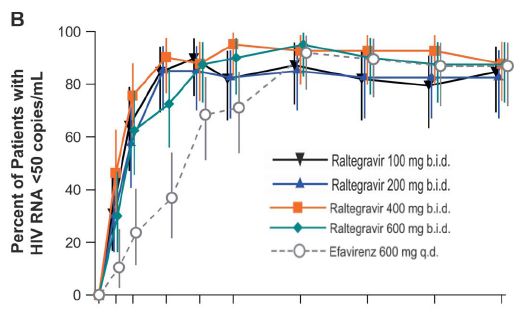
Verträglichkeit
In der genannten Studie bei Therapieerfahrenen fand sich keine Häufung von Nebenwirkungen verglichen mit Placebo und es zeigten sich auch keine Unterschiede bei den verschiedenen Dosierungen. Die Substanz wrid sehr gute toleriert. Aufgrund dieser Resultate wurde für die weitere Entwicklung in Phase III eine Dosis von 400mg bid gewählt.
Nachtrag 30.8.08: Bei Markteinführung galt Raltegravir tatsächlich als Substanz mit sehr geringem Toxizitätsprofil. Doch die Erfahrungen beruhen auf einer kleinen Zahl von behandelten Patienten. Mit der Markteinführung soll daher die Toxizität gut beobachtet werden. An der AIDS Konferenz in Mexico hat Markovitz 96-Woche Daten der o.g. Studie vorgestellt (TuAB0102). In dieser Präsentation wurde über eine CK-Erhöhung über das 10-fache der Norm bei 6% der Patienten berichtet. Ein Fallserie aus Vancouver berichtet über Fälle von Depressionen bei Beginn der RAL Therapie (Harris et al., AIDS 2008).
Ein Letter im AIDS (Fleischbein, Nov. 2008) berichtet über eine wahrscheinliche massive Erhöhung der alk. Phosphatase (>1000 IU/L) unter Raltegravir. Der Alk.P.-Spiegel hat sich nach Absetzen normalisiert und ist nach Re-Challenge wieder angestiegen, was eine Kausalität recht wahrscheinlich macht. Allerdings blieben in der Folge weitere Häufungen solcher Beobachtungen aus.
Die Verträglichkeit wie auch die Wirksamkeit von Raltegravir scheint unverändert gut bei Patienten mit Hepatitis B und C-Koinfektion, wie eine Analyse der drei RCT ergeben hat (Rockstroh et al, HIV Medicine, 2011).
Pharamkokinetik
Iwamoto et al. von Merck publizierten im Feb 08 in Mol Ther die ausführlichen Resultate der pharmakologischen Prüfung von Raltegravir. Darin wird klar, dass bereits ab einer Dosis von 100mg (bid) die Talspiegel bei allen gesunden Probanden oberhalb der Protein-korrigierten 95% TCID von 33ng/ml liegen. Dosen bis 800mg bid wurden durchwegs gut toleriert.
Penetration Genitaltrakt
Raltegravir scheint sehr gut in den männlichen Genitaltrakt zu gelangen. Eine kleine Pilot-Studie zeigte 1.6-6 mal höhere Raltegravir-Konzentrationen im Sperma als gleichzeitig im Blut (Calcagno 2010 AAC).
Einmal tägliche Gabe unterlegen
Im November 2010 musste Merck die Studie zur Wirksamkeit der einmal täglichen Gabe von Raltegravir abbrechen. Die einmal tägliche Einnahme war signifikant schlechter als die etablierte 2xtägl Einnahme (s. Bericht)