"Platelets: the other white cells"
Dieser spannende Vortrag war Teil einer Session über endovaskuläre Infektionen (die restlichen Vorträge brachten leider keine grossen Neuigkeiten).
Wirbellose kennen sogenannte Hemozyten, die je nach Bedarf unterschiedliche Funktionen ausüben: Hämostase oder Infektabwehr. Bei Säugern glaubte man lange an zellgebunde, getrennte Funktionen von Thrombozyten (Hämostase), Leukozyten (Entzündungsaktivität) und Lymphozyten (Immunabwehr). Dem ist aber natürlich nicht so! So stellt umgekehrt die Thrombopenie beispielsweise einen unabhängigen Risikofaktor für Infektanfälligkeit (Pneumonie, Bakteriämie, Fungämie) und für das Auftreten spezifischer Erkrankungen, wie die lymphozytäre Choriomeningitis dar!
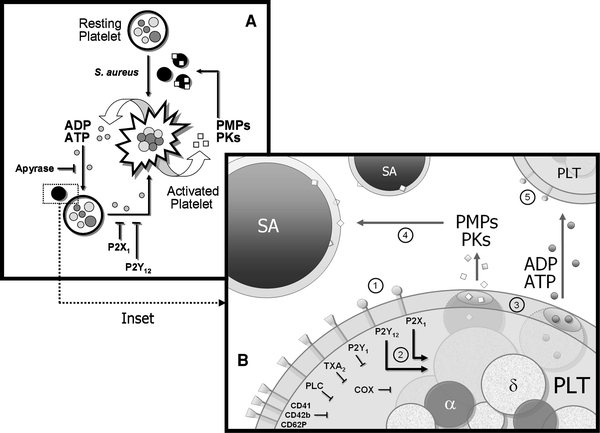
Reife Thrombozyten unterscheiden sich morphologisch durch die Art zytoplasmatischer Granula: Delta-Granula weisen in hoher Konzentration Mediatoren zur Modulation des Vasotonus auf (z.B. Serotonin), Alpha-Granula Proteine zur Hämostase und Adhäsion (z.B. Fibrinogen, von Willebrand Faktor) wie zur Reparatur von Endothelien und auch zur Microbicidät. Gamma-Granula enthalten Enzyme zur Auflösung von Thromben. Spezifische Agentien fördern spezifische Degranulationen (z.B. induziert ADP eine Delta- und Alpha-Degranulation).
Thrombozyten funktionieren modular („form follows function“) und sind also z.B. in die Koordination von Abwehrmechanismen integriert („immune syntax“). Thrombozyten können antigene Strukturen durch eigene TLR (toll like receptor) erkennen, was dann eine direkte antimikrobielle Kaskade zur Folge hat (z.B. Ausschüttung antimikrobieller Peptide). Werden Thrombozyten antimikrobiell aktiviert, kommt es auch zur Strukturänderung (Metamorphose) von primär discoidem zu amöboidem Zustand. Die Metabolik wird aktiviert und Rezeptoren werden exprimiert, die eine vermehrte Adhäsion zu verletztem oder infiziertem Gewebe aufweisen, zudem wird die gezielte Motilität zu entzündetem Gewebe hin gesteigert, Superoxide werden generiert und Pseudopodien werden verlängert, welche sowohl mit Mikroben wie mit körpereigenen Zellen interagieren können.
Thrombozyten sind auch Sensoren für Signale endothelialer Infektionen (sensing von struturell veränderter Oberflächenproteinen) und sind die am raschesten mobilisierte und zahlenmässig grösste Zellreihe, die am Ort einer vaskulären Infektion kumulieren.
Über TLR4 können Lipopolysacharide (LPS) die thrombozytäre Ausschüttung von Zytokinen, antimikrobiellen Peptiden („platelet microbicidal proteins“ = PMPs) und Kinocidinen bewirken. Thrombozytäre TLR4 weisen zudem aber auch neuartige Mechanismen der Immunabwehr auf: nach einem Sensing antigener Strukturen wird (mittels Detektion körpereigener Liganden) eine Plättchenadhäsion induziert, was ein Andocken neutrophiler Leukozyten zur Folge hat. Dies wiederum führt zur Neutrophilen-Aktivierung mit konsekutiver Bildung neutrophiler extrazellulärer Fallgruben („traps“), sogenannte NETs (Clark SL et al. 2007, Nat Med 13:463-9). Solche NETs fangen bakterielle Antigene ab und finden sich vorzugsweise in fenestrierten Geweben wie z.B. in Lebersinusioden und pulmonalen Kapillaren. Es ist somit vorstellbar, dass Thrombozyten durch die Interaktion mit Neutrophilen die bakterielle Clearance verstärken.
Die antimikrobielle Funktionalität von Thrombozten ist untenstehend exemplarisch anhand der Interaktion mit staph. aureus dargestellt: auf zellulärer Ebene (A) bewirken Staphylokokken via spezifischer Rezeptoren eine metamophotische Aktivierung von Thrombozyten mit Degranulation (Ausschüttung von PMP’s und Kinocidinen (PK’s), die in höheren Konzentrationen staphylocid wirken) und Sekretion von ADP/ATP, welche ihrerseits die Plättchenaktiverung fortsetzen. Auf molekularer Ebene (B) werden die spezifischen Rezeptoren P2Y und P2X ersichtlich, die die Ausschüttung von PMPs, PKs (aus Alpha-Granula) und ADP/ATP (aus Delta-Granula) induzieren.