Vertebrale Osteomyelitis – Der Schmerz im Rücken
Infektionen der Wirbelsäule bereiten gelegentlich grosses diagnostisches und therapeutisches Kopfzerbrechen. Eine gut gestaltete Übersichtsarbeit im NEJM von Kollege Werner Zimmerli aus Liestal fasst das heutige Wissen zum Management der vertebralen Osteomyelitis zusammen.
Wie kommt es zur Infektion der Wirbelsäule?
Vertebrale Osteomyelitiden entstehen entweder durch Streuung über die Blutbahn bei Endokarditis, durch direkte Inokulation nach Wirbelsäulenchirurgie oder per continuitatem bei einem Weichteilinfekt. Staphylokokkus aureus ist gefolgt von E. coli der häufigste Erreger. Beim Vorliegen Fremdkörperinfekten sind koagulase negative Staphylokokken und Propionibacterien die häufigsten Pathogene. Bezüglich Ursprung der vertebralen Infektion zitiert Zimmerli eine Studie, welche besagt, dass in nur 51% ein Fokus eruierbar ist: Oft sind es urogenitale und Weichteilinfektionen, Katheterinfekte, Endokarditis oder Arthritis. Als Komplikationen treten epidurale (17%) oder paravertebrale (26%) Abzesse oder Abzesse im Psoasmuskel auf.
Symptome
Klassischerweise zeigt sich eine Wirbelsäulenosteomyelitis mit Fieber und Rückenschmerzen, v.a. Ruheschmerzen welche auch nachts vorhanden sind. Dies ist jedoch nicht immer vorhanden. Rückenschmerzen kommen in 86% vor, Fieber nur in 35-60%. 38% der Patienten haben neurologische Ausfälle. Wirbelsäulenklopfschmerzen zeigen gemäss einer Studie nur 20% der Patienten!
Diagnose – daran denken und Bildgebung!
Weder die Leukozytengesamtzahl noch der Anteil der Neutrophilen > 80% haben eine gute Sensitivität. BSG und CRP hingegen sind hoch sensitiv, wobei der CRP-Wert auch ein guter Verlaufsparameter darstellt. Zur Diagnostik gehören Blutkulturen, wobei nur 58% positiv werden (30-78%). Entscheidend ist, dass man bei Vorliegen von Fieber und Rückenschmerzen an die Diagnose denkt. Die Bildgebung (v.a. MRI) ist der nächste Schritt. Bereits in frühen Stadien fällt die Flüssigkeitsansammlung vor derm Wirbelkörper (weisser Pfeil, Abb. rechts) und das Oedem von Diskus und Wirbelkörper (langer Pfeil) aber auch der epidurale Abszess hinter den Wirbelkörpern (kleine pfeile) auf.
Ist das MRI suggestiv für eine Osteomyelitis und bleiben die Blutkulturen negativ, sollte eine Biopsie gemacht werden – diese entweder CT-gesteuert oder offen. Wenn eine polymikrobielle Ursache der Osteomyelitis angenommen werden muss, zB bei Sepsis mit intraabdominalem Fokus, sollte in jedem Fall biopsiert werden. Die Proben (möglichst mehrere!) sollten auf Bakterien und Pilze kultiviert werden, bei suggstiver Anamnese sollten auch Mykobakterien oder Brucellen (Serologie!) gesucht werden.
Biopsie des Befundes
Wichtig immer auch, eine Beurteilung durch den Pathologen: Durch Beurteilung von Leukozytärer Infiltration und reaktiven Veränderungen lässt sich eine Kontamiantion von einer Infektion unterscheiden. Gerade beim Nachweis von koagulase negativen Staphylokokken oder zur Diagnose von Tuberkulose oder Brucellen (Granulome!) wird dies wichtig.
Ob offen oder CT-gesteutert biopsiert werden soll, entscheidet sich aufgrund des Angebots einer Klinik sowie derer jeweiligen Ausbeute – so Zimmerli. Ist trotz hohem Verdacht in der Bildgebung die CT-gesteuerte Biopsie ohne Wachstum muss offen biopsiert werden. Falsch negative Kulturen entstehen, wenn der Patient vor der Biopsie bereits Antibiotika erhalten hat. Vor Probenentnahme – wenn immer dies vertretbar ist – soll daher zwingend eine Antibiotika-Pause von mindestens 48h eingehalten werden, besser 1-2 Wochen.
Therapie – Keine empirische Antibiotikagabe
Grundsätzlich sollte eine Therapie nur begonnen werden, wenn ein Keim in den Kulturen wächst. Also: Geduld! Die Wahl der Therapie ist in der Tabelle dargestellt (klick auf Abbildung zur grösseren Darstellung). Bezüglich der Therapiedauer gibt es keine klaren 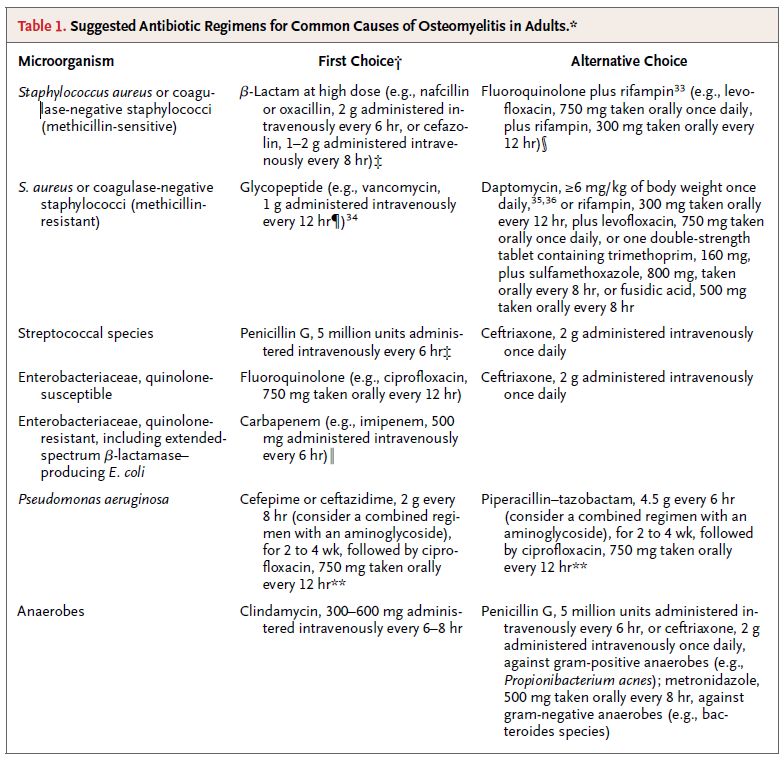 Daten aus kontrollierten Studien. 4-6 Wochen bis 3 Monate Antibiotika-Therapie werden empfohlen. Gemäss einer einzelnen Studie soll eine Therapiedauer von mehr als 6 Wochen lediglich bei Patienten mit nicht drainierbaren Abszessen oder Fremdkörpern einen Vorteil gezeigt haben. Insgesamt empfiehlt Zimmerli also 6 Wochen.
Daten aus kontrollierten Studien. 4-6 Wochen bis 3 Monate Antibiotika-Therapie werden empfohlen. Gemäss einer einzelnen Studie soll eine Therapiedauer von mehr als 6 Wochen lediglich bei Patienten mit nicht drainierbaren Abszessen oder Fremdkörpern einen Vorteil gezeigt haben. Insgesamt empfiehlt Zimmerli also 6 Wochen.
Abgesehen von Infektionen mit Fremdkörpern (wo Rifampicin eingesetzt werden sollte) ergaben sich keine Unterschiede im Outcome bezüglich der verschiedenen antibiotischen Therapien. Auch war die intravenöse Therapie der peroralen Gabe von Fluorochinolonen (Therapie erster Wahl bei gram-neg. Erregern) nicht überlegen.
Anders aber bei Grampositiven! Dort soll wegen hohem Risiko einer Resistenzbildung keine Monotherapie mit Chinolonen durchgeführt werden! Hier ist die iv-Therapie der Standard, wobei gemäss expert-opinion rasch auf eine orale Therapie mit Ciproxin und Rimactan gewechselt werden kann, wenn der Keim auf beide Substanzen sensibel ist. Bezüglich Dalacin fehlen leider gute Daten. Betalaktame sollten wegen schlechter Bioverfügbarkeit nur iv verabreicht werden. Für Ertapenem iv fehlen genügend Daten und eine Fallbeschreibung eines dokumentierten Therapieversagens warnt vor dem Einsatz in dieser Situation.
Wann ist Chirurgie nötig?
Ein chirurgisches vorgehen ist bei akuter hämatogen gestreuter Osteomyelitis selten nötig, ausser zur Diagnostik, wenn die Blutkulturen negativ bleiben oder wenn ein Abzess vorhanden ist. Dieser kann aber auch CT-gesteuert drainiert werden. Im Falle eines Fremdkörperinfekts hingegen muss immer ein chirurgisches Debridement erfolgen. Falls das Impantat schon länger als 30 Tage implantiert ist, sollte es entfernt werden.
Was nützen Verlaufs-Bilder mittels MRI?
Grundsätzlich ist davon abzuraten. Solange Klinik und Labor d.h. CRP und Schmerzen eine Besserung zeigen, hilft uns das MRI nicht weiter. Meist bleiben die Befunde im MRI noch lange nachweisbar. Indiziert ist eine Nachkontrolle mit MRI nur, wenn nach ca. 4 Wochen keine eindeutige Besserung (CRP/Schmerzen) eintritt oder neurologische Probleme auftauchen (Abscess!). Einzig im Falle eines Abzesses, welcher nicht drainiert wurde, sollte vor Stop der Antibiotika routinemassig ein MRI gemacht werden um zu sehen, ob noch Kollektionen vorhanden sind, was eine Therapieverlängerung bedeuten würde.
Was tun wenn alle Kulturen negativ bleiben?
In diesem Falle empfiehlt Zimmerli eine PCR aus dem Biopsiematerial. In Frage kommen Anerobier, Kingellen, Bartonellen oder auch Tropheryma, welche alle schwierig anzuzüchten sind.
Kurz: nichts Neues aber eine gute Übersicht über den Stand des aktuellen Wissens!
Quelle: Zimmerli W. NEJM 2010 Mar 18;362(11):1022-9